
分析 (1)①室温下取0.2mol•L-1HCl溶液与0.2mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,说明得到的盐是强酸弱碱盐,其溶液呈酸性,含有弱根离子的盐促进水电离;
②根据物料守恒和电荷守恒计算离子浓度大小;
(2)MOH为弱电解质,二者混合后碱过量,溶液显示碱性;根据MCl的水解方程式M++H2O?MOH+H+写出水解平衡常数表达式,再根据水的离子积及MOH的电离常数计算出Kh;
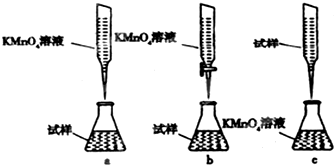
(3)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
②润洗时应尽量将待装液润洗整个滴定管,可边倾斜边转动;
③酸性溶液或强氧化性溶液应用酸式滴定管.
解答 解:(1)①等体积等浓度的盐酸和MOH恰好反应生成盐,得到的盐溶液呈酸性,说明该盐是强酸弱碱盐,含有弱根离子的盐促进水电离,酸抑制水电离,所以混合溶液中水电离出的c(H+)>0.2 mol•L-1 HCl溶液中水电离出的c(H+),即A>B,
故答案为:>;
②根据电荷守恒c(M+)+c(H+)=c(Cl-)+c(OH-)得:c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6 mol/L-10-8 mol/L=9.9×10-7mol•L-1,
故答案为:9.9×10-7;
(2)25℃时,0.01mol•L-1 MOH溶液的pH=10,氢氧根离子浓度为10-4mol•L-1,pH=4的盐酸中氢离子浓度为10-4mol•L-1,由于MOH为弱碱,则反应后MOH过量,溶液显示碱性,即pH>7;MCl的水解方程式为:M++H2O?MOH+H+,则溶液中MCl的水解平衡常数Kh=$\frac{c(MOH)•c({H}^{+})}{c({M}^{+})}$=$\frac{\frac{{K}_{W}}{c(O{H}^{-})}}{\frac{c({M}^{+})}{c(MOH)}}$=$\frac{{K}_{W}}{{K}_{b}}$=10-8mol/L,
故答案为:>;10-8;
(3)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
故答案为:250mL容量瓶;
②润洗时应尽量将待装液润洗整个滴定管,可边倾斜边转动,操作方法为彺滴定管中加入3到5ml 润洗液,将滴定管倾斜,使略有角度,旋转360度,将润洗液倒掉,重复3次,故答案为:彺滴定管中加入3到5ml 润洗液,将滴定管倾斜,使略有角度,旋转360度,将润洗液倒掉,重复3次;
③酸性溶液或强氧化性溶液应用酸式滴定管,故答案为:b.
点评 本题综合考查学生对实验原理与实验操作的理解、氧化还原反应滴定、化学计算等,为高考常见题型,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
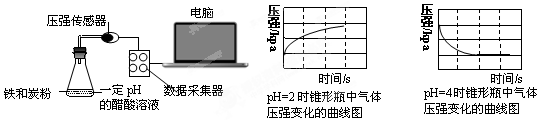
| A. | 溶液pH≤2时,生铁发生析氢腐蚀 | |
| B. | 生铁的腐蚀中化学腐蚀比电化学腐蚀更普遍 | |
| C. | 在酸性溶液中生铁可能发生吸氧腐蚀 | |
| D. | 两溶液中负极反应均为:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素形成的单质熔沸点自上而下逐渐升高 | |
| B. | 核外电子排布相同的微粒化学性质一定相同 | |
| C. | 同主族元素最高价含氧酸的酸性随核电荷数的增加而减弱 | |
| D. | 非金属元素的气态氢化物的稳定性越强其沸点就越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从溴水中萃取溴,可用酒精做萃取剂 | |
| B. | 蒸发实验完毕后,发现蒸发皿炸裂,这是因为没有垫石棉网 | |
| C. | 萃取碘水溶液中碘,分离碘四氯化碳溶液时,眼睛注视分液漏斗里液面 | |
| D. | 蒸馏时,为了加快水的流速,水应从上口进入,下口流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
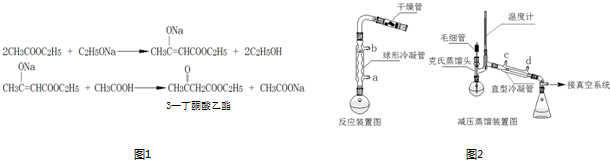
 CH3COOCH2CH3+H2O,反应类型是酯化反应.
CH3COOCH2CH3+H2O,反应类型是酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| E/(KJ•mol-1) | 803 | 742 | 577 | 339 | 465 |
| 达到平衡所需的时间/min | a的数值 | b的数值 | |
| 催化剂A | t | a1 | b1 |
| 催化剂B | 2t | a2 | b2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
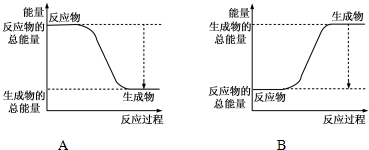
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,4 v正(O2)=5 v逆(NO) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 达到平衡时,若减小容器体积,则NH3的转化率会增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com