
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量的铝铁合金与100mL很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4 mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
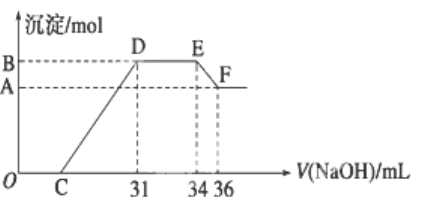
(1)结合OH-的能力最弱的是________(填离子符号)
(2)B与A的差值为________mol.
(3)原混合物中铝粉与铁粉的物质的量之比为______.
(4)B点对应的沉淀量为________mol,C点对应的溶液体积为________mL.
(5)硝酸溶液的物质的量浓度为_________mol·L-1
(6)写出铝与该浓度硝酸反应的离子方程式_____________________。
【答案】NH4+ 0.008 1:3 0.032 7 1.48mol·L-1 8Al+30H++3NO3-===8Al3++3NH4++9H2O
【解析】
铝粉和铁粉的混合物与100 mL很稀HNO3充分反应,被氧化为Al3+、Fe3+,反应始终没有气体生成,可知不会有氮的氧化物生成,根据题设条件可知,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素在该反应过程中由+5价变成了较低的价态-3价,结合图像可以看出硝酸过量,加入氢氧化钠溶液应先与硝酸发生中和反应,再生成沉淀,当沉淀完全后,继续加入氢氧化钠溶液,沉淀量不变,则OH-与溶液中的NH4+发生了反应,再继续滴加氢氧化钠,氢氧化铝沉淀被溶解,故结合图像可分析出随着氢氧化钠的不断滴加,溶液中发生的反应的依次为:OC段:H++OH- = H2O,CD段:Fe3++3OH- = Fe(OH)3↓,Al 3++3OH- = Al(OH)3↓,DE段:NH4++ OH-═NH3H2O,EF段:Al(OH)3+OH-=AlO2-+2H2O,据此分析作答。
(1)D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH的反应,所以溶液中结合OH-的能力最弱的是NH4+,
故答案为:NH4+;
(2)E与F之间沉淀的量减少,因为Al(OH)3溶解在氢氧化钠溶液中,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,则溶解的沉淀的物质的量(B与A的差值)等于EF阶段消耗的氢氧化钠的物质的量,为4 mol/L![]() (36 mL-34 mL)
(36 mL-34 mL)![]() 10-3 = 0.008 mol,
10-3 = 0.008 mol,
故答案为:0.008 mol;
(3)根据铝元素守恒可知,设参与反应的铝的物质的量为x mol,则
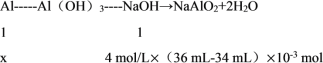
解得x = 0.008 mol,
即铝的物质的量是0.008 mol;
又DE段是NH4NO3和NaOH反应,根据关系式NH4NO3~NaOH得n(NH4NO3)=n(NaOH)=(34-31)×10-3 L×4 mol/L = 0.012 mol,
设铁有y mol,Al离子也是0.008 mol,NH4+有0.012 mol,根据电子转移数守恒可得:
3x+0.008×3=0.012×8,
y = 0.024 mol,
所以铁离子有0.024 mol,根据原子守恒知,铁的物质的量是0.024mol,则原混合物中铝粉与铁粉的物质的量之比为0.008 mol:0.024 mol = 1:3,
故答案为:1:3;
(4)B为沉淀的最大值,沉淀为Al(OH)3和Fe(OH)3,根据元素守恒法可知,其物质的量分别为铝粉和铁粉的物质的量,为0.008 mol+0.024 mol = 0.032 mol;根据图象确定C点消耗氢氧化钠的量.滴加NaOH体积为31 mL时,
发生反应为①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,
可计算得出C点氢氧化钠溶液的体积为31 mL-![]() 103 mL/L = 7 mL,
103 mL/L = 7 mL,
故答案为:0.032 mol;7;
(5)E点时,溶液中的溶质是硝酸钠和氨水,n(NH3H2O)=n(NH4+)=0.012 mol,n(NaNO3)=n(NaOH)= 34×10-3 L×4mol/L = 0.136 mol,根据氮原子守恒知,c(HNO3)=![]() =
= ![]() = 1.48 mol/L,
= 1.48 mol/L,
故答案为:1.48;
(6)根据题意可知,该浓度的硝酸与铝反应时,得到的氮元素化合价为-3价,根据氧化还原反应的规律配平该离子方程式得,8Al+30H++3NO3-===8Al3++3NH4++9H2O,
故答案为:8Al+30H++3NO3-===8Al3++3NH4++9H2O。


科目:高中化学 来源: 题型:
【题目】按右下图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)( )

A. C1上发生还原反应
B. M 装置中SO42-移向Cu电极
C. 工作一段时间后装置M 中溶液pH变小,装置N中溶液pH变大
D. Cu电极与C2电极上的电极反应相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,1mol N2和3mol H2混合后反应,达到平衡时测得混合气体的密度是同温同压下氢气的5倍,则氮气的转化率为( )
A. 20% B. 30% C. 40% D. 50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C分别代表中学化学中常见物质,请根据题目要求回答下列问题:
(1)实验室常用A的饱和溶液制备微粒直径为lnm-100nm的红褐色液相分散系,则该反应的化学方程式为:_____,将A的溶液加热蒸干并灼烧,得到固体的化学式为:_____。
(2)B为地壳中含量最高的金属元素的氯化物,向50.0mL,6mol/L的B溶液中逐滴滴入100mL某浓度的KOH溶液,若产生7.8g白色沉淀,则加入的KOH溶液的浓度可能为____。
(3)将A、B中两种金属元素的单质用导线连接,插入一个盛有KOH溶液的烧杯中构成原电池,则负极发生的电极反应为:_______。
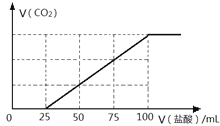
(4)C是常见温室气体,将一定量的气体C通入100mL 某浓度的KOH得溶液F,向F溶液中逐滴加入2 molL-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。则F溶质与足量石灰水发生反应最多可得沉淀的质量为____g。
(5)pH = 3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液。若溶液的pH偏高,则碱式硫酸铝产率降低且有气体C产生,用化学方程式表示其原因_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①Cu丝 ②Cl2 ③Al2(SO4)3溶液 ④蔗糖 ⑤浓硝酸⑥Ca(OH)2⑦NH4Cl⑧CO2 ⑨氨水
请用以上相应的数字编号和化学用语回答问题:
(1)属于电解质的是__________;属于非电解质的是__________.
(2)实验室制取氨气的化学反应方程式_______________________.
(3)工业制漂白粉的化学反应方程式__________________________.
(4)实验室制Al(OH)3的离子方程式______________________________________________________
(5)①和⑤的化学方程式并用双线桥标出电子转移__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2molA和3molB充入一密闭的容器中发生反应:aA(g)+B(g)![]() C(g)+D(g),5 min后达平衡。已知该反应在此温度下平衡常数K=1,若温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
C(g)+D(g),5 min后达平衡。已知该反应在此温度下平衡常数K=1,若温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
A. a="3" B. a="2" C. B的转化率为40% D. B的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒常用焦亚硫酸钠(Na2S2O5)作抗氧化剂。某兴趣小组用下图装置(夹持装置略)测定某葡萄酒中抗氧化剂的残留量(以游离的SO 2计算),方案如下:向B中加入300.00mL葡萄酒和适量的稀硫酸,加热使SO2全部逸出并与C中H2O2完全反应,除去C中过量的H2O2后,将C中液体转移至小烧杯中,向烧杯内逐滴加入BaCl2溶液至沉淀量不再增加,过滤出沉淀,经洗涤、干燥后,称得固体的质量为0.2796g,则该葡萄酒中SO2的含量为
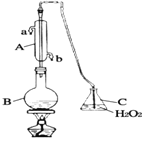
A. 0.256 g/L B. 0.04 g/L C. 0.24 g/L D. 0.0768 g/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式:_______;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
,请写出此反应的热化学方程式:_______;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~5min内,以CO2表示的该反应速率v(CO2)=______,该条件下的平衡常数K=________。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______移动(填“正向”“逆向”或“不”);最终达平衡时NO的转化率a=______________。
(3)在25 ℃下,向浓度均0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_____沉淀(填化学式),当两种沉淀共存时,溶液中c(Mg2+)/c(Cu2+)=__________(已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;A、D同主族,D的焰色反应为黄色;E的简单阳离子与X具有相同电子数,且E是同周期中简单离子半径最小的元素;F元素的原子最外层比次外层少两个电子,C、G两种元素的原子最外层共有13个电子。则
(1)F在元素周期表中的位置为_______________。
(2)在2 L的密闭容器中,充入2 mol B2和3 mol A2,在一定条件下发生反应,5 s后测得A2为1.8 mol,则以B2的表示的反应速率v(B2)为__________________________。
(3)常温下,液态的B2A4与气态的BC2两者发生反应生成无毒物质,16g B2A4发生反应放热akJ,该反应的热化学方程式为_______________。
(4)D2F溶液在空气中长期放置发生反应,生成一种强碱与D2F2。D2F2与过氧化钠的结构和化学性质相似,其溶液显黄色。D2F2的电子式为_______,写出D2F在空气中长期放置生成D2F2的化学反应方程式为:_____________。D2F2的溶液与稀硫酸反应产生的现象为_____________。
(5)化学家发现一种化学式为A4B4的离子化合物,一定条件下1mol A4B4熔融电离生成两种离子各1mol,则该物质熔融时的电离方程式为____________。
(6)向30mL某浓度由A、B、C、D中三种元素形成一元强碱溶液通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。

则曲线Y表明M中的溶质为________;原NaOH溶液的物质的量浓度为_______;由曲线X、Y可知,两次实验通入的CO2的体积比为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com