
| A. | 元素的相对原子质量呈周期性变化 | |
| B. | 元素的原子半径呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
分析 根据元素周期律可知,元素的性质随原子序数的递增而呈现周期性的变化,而这种变化是由原子的电子排布的周期性变化引起,而与相对原子质量、元素金属性和非金属性、原子半径等没有必然关系,据此进行判断.
解答 解:A.结构决定性质,相对原子质量的递增与元素性质的变化没有必然的联系,故A错误;
B.元素的原子半径的变化属于元素的性质,不能解释元素性质的周期性变化,故B错误;
C.元素的金属性和非金属性都是元素的性质,不能解释元素性质的周期性变化,故C错误;
D.由原子的电子排布可知,随原子序数的递增,原子结构中电子层数和最外层电子数呈现周期性变化,则元素原子的核外电子排布的周期性变化是元素的性质呈周期性变化的根本原因,故D正确;
故选D.
点评 本题考查元素周期律的实质,题目难度不大,明确原子结构与元素周期律的关系为解答关键,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 2mol甲醇参加反应,放出的热量为25kJ | |
| B. | 浓硫酸在反应中只作催化剂 | |
| C. | 2υ(CH3OH)=υ(CH3OCH3) | |
| D. | 升高温度或增大压强均可加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
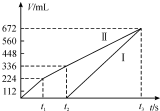 常温下用惰性电极电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题,(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)
常温下用惰性电极电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题,(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(s)+O2(g)=SO2(g),反应放出的热量大于293.23 kJ•mol-1 | |
| B. | S(g)+O2(g)=SO2(g),反应放出的热量小于293.23 kJ•mol-1 | |
| C. | 1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和 | |
| D. | 1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8 g O2含有电子数目为4NA | |
| B. | 1 L 0.1mol/L的氯化铵溶液中NH4+的数目为0.1NA | |
| C. | 常温常压下,22.4L氯气与足量的镁粉反应,转移的电子数为2NA | |
| D. | 含1mol FeCl3的饱和溶液滴入沸腾蒸馏水中,所得红褐色液体中含胶粒数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 或
或 .
. 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 在25℃,1.01×105Pa时,2 g氢气完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol | |
| D. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的氢氧化钠溶液混合,放出的热量等于57.3 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com