
| A. | Cl | B. | O | C. | KMnO4 | D. | HCl |
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:实验题
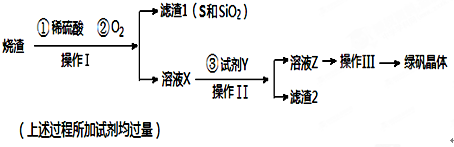
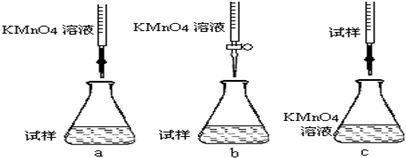
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解 | |
| B. | 滤去不溶性杂质后,将滤液移至坩埚内加热浓缩 | |
| C. | 除去粗盐中的Mg2+应加入过量的KOH,然后过滤 | |
| D. | 粗盐提纯最后一步应向滤液中加入盐酸,调节溶液的值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+,K+,MnO4-,Cl- | B. | Na+,H+,NO3-,SO42- | ||
| C. | K+,Ca2+,NO3-,CO32- | D. | Cu2+,Na+,Cl-,SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变压强对该平衡的移动无影响 | |
| B. | 正反应是放热反应且A不是气态 | |
| C. | 其它条件不变,加入少量A,该平衡向正反应方向移动 | |
| D. | 正反应是吸热反应且A不是气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质所含离子 | SO42- | M | Mg2+ | Fe2+ |
| 物质的量浓度 | c | 3 | 3 | 2 |
| A. | 若M是NO3-,则c为3.5 | |
| B. | 若使Fe2+浓度降低,可以加入试剂NaOH | |
| C. | 若M是NH4+,则配制溶液所用的溶质不一定是3种 | |
| D. | 若加入BaCl2溶液能产生两种沉淀,则M可能是CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com