
【题目】A、B两种烃,它们含碳质量分数相同,下列关于A和B的叙述正确的是( )
A.A和B一定是同分异构体
B.A和B不可能是同系物
C.A和B最简式一定相同
D.A和B的化学性质相似
科目:高中化学 来源: 题型:
【题目】向100mLNaBr和NaI的混合溶液中缓慢通入适量的Cl2,充分反应后将所得溶液蒸干,并将所得固体灼烧至恒重,得到mg固体。m与通入Cl2的体积[V(Cl2),标准状况]关系如图所示。则下列说法不正确的是
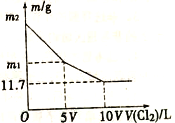
A. V=0.224 B. 混合溶液中:c(Na+)=2 mol/L
C. m2=25.3 D. m1=18.55
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的熔沸点高低比较正确的是( )
A.邻二甲苯( ![]() )、邻羟基苯甲醛(
)、邻羟基苯甲醛( ![]() )熔沸点均于其对应对位取代物
)熔沸点均于其对应对位取代物
B.卤素元素的单质及其氢化物的熔沸点随原子半径的增大而升高
C.石墨、金刚石、碳化硅、晶体硅、白磷、水、干冰熔沸点依次降低
D.NaCl、MgCl2、MgO,Al2O3熔沸点依次减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能在指定溶液中大量共存的是( )
A.无色溶液中:Na+、MnO4﹣、CO32﹣、Cl﹣
B.能使紫色石蕊试剂变红的溶液中:OH﹣、K+、Ba2+、Na+
C.透明的酸性溶液中:Fe3+、Mg2+、Cl﹣、NO3﹣
D.pH=1的溶液中:NH4+、Fe2+、Cl﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种化合物均由原子序数小于18的元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。请回答:
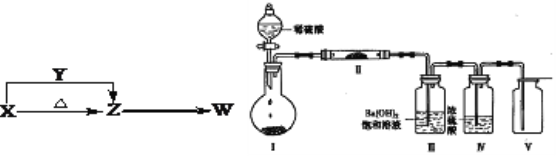
(1)W的化学式是______________。
(2)X与Y在溶液中反应的离子方程式是_________________________________。
(3)某实验小组利用上图装置(夹持固定装置已略去)进行实验,装置Ⅰ中为X,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。
①装置Ⅰ中反应的化学方程式是__________________________________,装置Ⅱ中主要的化学反应方程式是__________________________________。
②Ⅱ中的物质中阳离子与阴离子个数比是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2样品,请设计实验测定该样品的纯度。可供选择的装置如图:
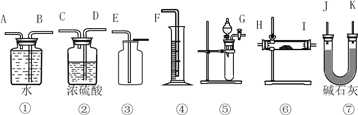
(1)选用上述装置可以组装一套最简单的测定过氧化钠样品纯度的实验装置,选择的仪器组合是____________。
A.①②④⑤ B.①④⑤
C.⑤⑥⑦ D.①③⑤⑦
(2)实验中选用装置的连接顺序是_________________(填各接口的字母,连接胶管省略)。
(3)写出实验中Na2O2发生反应的化学方程式,并用双线桥标注电子转移的方向和数目__________。若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为168mL(标准状况),则Na2O2试样的纯度为_________。
(4)向紫色石蕊试液中加入Na2O2粉末,振荡,正确的叙述是________。
A.最后溶液变蓝 B.溶液先变蓝后褪色
C.溶液仍为紫色 D.因为Na2O2与石蕊发生氧化还原反应而无气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,隔板K可左右移动,甲中充入2mol A和1mol B,乙中充入2mol C和1mol He,此时K停在0处.发生反应2A(g)+B(g)2C(g),达到平衡后,恢复至温度.下列有关说法不正确的是
( )
A.达平衡后,隔板K最终停留在左侧刻度0~2之间
B.若平衡时K停留在左侧1处,则活塞停留在右侧6处
C.达到平衡时,甲容器中B的物质的量小于于乙容器中B的物质的量
D.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸钠(NaA)可用作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A﹣ , 在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,已知25℃时,HA、H2CO3的电力平衡常数分别为K=6.25×10﹣5、K1=4.3×10﹣7 , 下列说法正确的是(不考虑饮料中其他成分)( )
A.提高CO2充气压力,饮料中c(A﹣)不变
B.当pH为5.0时,饮料中 ![]() =0.16
=0.16
C.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
D.结合H+的能力:A﹣>HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温裂解法处理工业废硫酸的原理为:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol,它由两步反应组成:
i.H2SO4(l)=SO3(g)+H2O(g)△H=+177kJ/mol
ii.SO3(g)分解.
(1)SO3(g)分解的热化学方程式为
(2)工业上常用SO2制备Na2S2O3 , 向0.1mol/L的Na2S2O3溶液中滴加稀硫酸的离子方程式为 .
(3)反应ii的△S0 (填“>”、“<”、“=”).
(4)对反应ii,可用V2O5作催化剂. 已知:SO2+V2O5SO3+V2O4K1、 ![]() O2+V2O4V2O5K2 , 则在相同温度下,2SO3(g)2SO2(g)+O2(g)的平衡常数 K=(用K1、K2表示).
O2+V2O4V2O5K2 , 则在相同温度下,2SO3(g)2SO2(g)+O2(g)的平衡常数 K=(用K1、K2表示).
(5)L(L1、L2),X可分别代表压强或温度,如图表示L一定时,反应ii中SO3(g)的平衡转化率随X的变化关系. 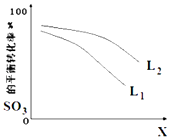
①X代表的物理量是;
②比较L1、L2的大小 .
(6)维持体系总压p恒定,在T℃时,物质的量为9mol、体积为2L的SO3(g)发生反应:2SO3(g)2SO2(g)+O2(g),已知SO3的平衡转化率25%,则在该温度下反应的平衡常数K=(用最简分数表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com