
【题目】已知:将Cl2通人适量KOH溶液中,产物中可能有KCl、KClO、KClO3,且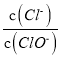 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
A. 若某温度下,反应后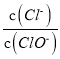 =3,则溶液中
=3,则溶液中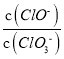 =5:2
=5:2
B. 参加反应的氯气的物质的量等于0.5amol
C. 改变温度,反应中转移电子的物质的量ne-的范围: ![]()
D. 改变温度,产物中KCl的最大理论产量为![]() mol
mol
【答案】D
【解析】A.设n(ClO-)=1mol,反应后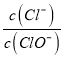 =3,则n(Cl-)=3mol,电子转移守恒,5×n(ClO3-)+1×n(ClO-)=1×n(Cl-),即:5×n(ClO3-)+1×1mol=1×3mol,解得:n(ClO3-)=
=3,则n(Cl-)=3mol,电子转移守恒,5×n(ClO3-)+1×n(ClO-)=1×n(Cl-),即:5×n(ClO3-)+1×1mol=1×3mol,解得:n(ClO3-)=![]() mol,故溶液中
mol,故溶液中 =
=![]() ,故A正确;B.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH),故参加反应的氯气的物质的量为:n(Cl2)=
,故A正确;B.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH),故参加反应的氯气的物质的量为:n(Cl2)= ![]() n(KOH)=0.5a mol,故B正确;C.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n(KClO3)=
n(KOH)=0.5a mol,故B正确;C.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n(KClO3)= ![]() n(KOH)=
n(KOH)= ![]() a mol,转移电子最大物质的量为:
a mol,转移电子最大物质的量为: ![]() a mol×5=
a mol×5=![]() a mol,氧化产物只有KClO时,转移电子最少,根据电子转移守恒n(KCl)=n(KClO),根据钾离子守恒:n(KCl)+n(KClO)=n(KOH),故:n(KClO)=
a mol,氧化产物只有KClO时,转移电子最少,根据电子转移守恒n(KCl)=n(KClO),根据钾离子守恒:n(KCl)+n(KClO)=n(KOH),故:n(KClO)= ![]() n(KOH)=
n(KOH)= ![]() a mol,转移电子最小物质的量=
a mol,转移电子最小物质的量=![]() a mol×1=
a mol×1=![]() a mol,则反应中转移电子的物质的量ne的范围为:
a mol,则反应中转移电子的物质的量ne的范围为: ![]() a mol≤ne≤
a mol≤ne≤![]() a mol,故C正确;D.氧化产物只有KClO3时,转移电子最多,则生成的KCl的物质的量最大,由C中计算可知:n最大(KClO3)=
a mol,故C正确;D.氧化产物只有KClO3时,转移电子最多,则生成的KCl的物质的量最大,由C中计算可知:n最大(KClO3)= ![]() n(KOH)=
n(KOH)= ![]() a mol,则n最大(KCl)=
a mol,则n最大(KCl)= ![]() n(KOH)=
n(KOH)= ![]() a mol,故D错误;故选D。
a mol,故D错误;故选D。


科目:高中化学 来源: 题型:
【题目】为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
①锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为。
②装置B所盛的试剂是 , 其作用是。
③装置C所盛试剂是 ,
C中反应的离子方程式是。
④由此可得出的结论是:酸性>>。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.若烃中碳、氢元素的质量分数相同,则为同系物
B.CH2═CH2和CH2═CH﹣CH═CH2互为同系物
C.![]() 和
和 ![]() 互为同分异构体
互为同分异构体
D.同分异构体的化学性质可能相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按照单质、化合物、混合物顺序排列的是( )
A. 石墨 Fe(0H)3胶体 澄清石灰水 B. 氮气 干冰 冰水混合物
C. 液态氧 CuSO4·5H2O 浓硫酸 D. 硫粉 碘酒 含氧40%的氧化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】椰树牌天然矿泉水的成分:含钠46.31g/L、含钙35.11g/L、含碘0.051g/L…,这里所标成分钠、钙、碘指的是( )
A.元素
B.单质
C.原子
D.氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组只领取下列仪器或用品:冷凝管、牛角管、铁架台、铁圈、三角架、石棉网、烧杯、锥形瓶、普通漏斗、酒精灯、玻璃棒、量筒、蒸发皿、蒸馏烧瓶、温度计、滤纸、火柴。只应用上述仪器或用品,不能进行的实验操作是( )
A. 蒸发 B. 过滤 C. 萃取 D. 蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了验证反应物浓度对反应速率的影响,选用硫酸酸化的高锰酸钾溶液与草酸溶液在室温下进行反应. 实验中所用的草酸为稀溶液,可视为强酸.
(1)将高锰酸钾氧化草酸的离子方程式补充完整. 2MnO4﹣+C2O42﹣+=2 Mn2++CO2↑+H2O
(2)该小组进行了实验I,数据如表.
H2SO4溶液 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.1mol/L | 2:03 |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
一般来说,其他条件相同时,增大反应物浓度,反应速率.
但分析实验数据,得到的结论是 .
(3)该小组欲探究出现上述异常现象的原因,在实验I的基础上,只改变草酸溶液浓度进行了实验II,获得实验数据并绘制曲线图如图. 
①用文字描述曲线图表达的信息 .
②该小组查阅资料获取如下信息,其中能够解释MO变化趋势的是 .
a | KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II).(括号中罗马数字表示锰的化合价) |
b | 草酸根易与不同价态锰离子形成较稳定的配位化合物. |
c | 草酸稳定性较差,加热至185℃可分解. |
(4)该小组为探究ON段曲线变化趋势的原因,又进行了实验III,所得数据如表.
H2SO4溶液 | Na2SO4固体 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 0.1mol/L | 1.9×10﹣3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 16:20 |
1mL 0.5mol/L | 1.5×10﹣3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 8:25 |
1mL 1.0mol/L | 1.0×10﹣3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 6:15 |
1mL 2.0mol/L | 0 | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
该小组进行实验III的目的是 .
(5)综合实验I、II、III,推测造成曲线MN变化趋势的原因.为验证该推测还需要补充实验,请对实验方案进行理论设计.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
![]()
①写出由石英砂和焦炭在高温下制备粗硅的化学反应方程式:_____________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种气体,写出配平的化学反应方程式: _____________;H2还原SiHCl3过程中若混入O2,可能引起的后果是______________。
(2)下列有关硅材料的说法正确的是_____________ (填字母代号)。
A.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
B.石英坩埚耐高温性强,可用于加热熔融氢氧化钠
C.神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料单晶硅也可以制作电脑芯片
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故可采用盐酸为抛光液抛光单晶硅
F.玛瑙饰品的主要成分与建筑材料砂子相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某羧酸酯的分子式为C19H28O5 , 1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为( )
A.C15H24O5
B.C15H18O4
C.C15H20O5
D.C15H12O5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com