
【题目】为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
①锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为。
②装置B所盛的试剂是 , 其作用是。
③装置C所盛试剂是 ,
C中反应的离子方程式是。
④由此可得出的结论是:酸性>>。
【答案】盐酸;饱和NaHCO3溶液;吸收HCl气体;Na2SiO3溶液;SiO32-+CO2+H2O===H2SiO3↓+CO32-;HCl;H2CO3;H2SiO3
【解析】根据强酸+弱酸盐―→弱酸+强酸盐分析可知,分液漏斗中盛装盐酸,A中盛放Na2CO3 , 根据Na2CO3+2HCl===2NaCl+H2O+CO2↑可以知道酸性HCl强于H2CO3 , 然后将生成的CO2通入Na2SiO3溶液中,反应为Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3 , 由此判断酸性H2CO3>H2SiO3 , 但需注意的是A中反应会有HCl气体逸出,故通入Na2SiO3溶液前需将HCl吸收,但不能吸收CO2 , 故可选用饱和NaHCO3溶液。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1 , ②X(g)→C(g)△H2 , 反应过程中能量变化如图所示,E1表示A(g)+B(g)→X(g)的活化能,下列说法正确的是( ) 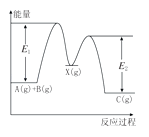
A.△H=E1﹣E2
B.E1是反应①的活化能
C.X是反应A(g)+B(g)→C(g)的催化剂
D.△H2>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是 ( )
A. 摩尔是物质的质量的单位 B. 阿伏加德罗常数约为6.02×1023 mol-1
C. 碳的摩尔质量为12 g D. 气体摩尔体积为22.4 L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》冲收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和精人甑,蒸令气上……其清如水,球极浓烈,盖酒露也。”这里所用的“法”悬指
A. 萃取 B. 过滤 C. 蒸馏 D. 干馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量由镁和铝组成的合金投入200 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加6 mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如下图所示:

下列说法不正确的是
A. 镁铝合金中,Mg与Al的物质的量之比为 2∶1
B. 所用盐酸的物质的量浓度为4 mol/L
C. 图像中的x=20
D. 图像中,Ox 段的离子方程式为:H++OH-= H2O;y~150 段的离子方程式为:Al(OH)3+OH-=AlO2-+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,所使用的仪器能够达到目的是( )
A.用5 mL量筒准确量取4.55 mL水
B.用托盘天平准确地称取6.82 g食盐
C.用广泛pH试纸测得某盐酸的pH为3.5
D.做KMnO4分解实验时用大试管作反应器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列四种铁的化合物溶于稀盐酸,滴加硫氰化钾溶液没有颜色变化,再加入氯水即呈红色的是( )
A.FeS
B.Fe2O3
C.FeCl3
D.Fe2(SO)4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通人适量KOH溶液中,产物中可能有KCl、KClO、KClO3,且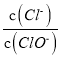 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
A. 若某温度下,反应后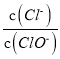 =3,则溶液中
=3,则溶液中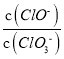 =5:2
=5:2
B. 参加反应的氯气的物质的量等于0.5amol
C. 改变温度,反应中转移电子的物质的量ne-的范围: ![]()
D. 改变温度,产物中KCl的最大理论产量为![]() mol
mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com