
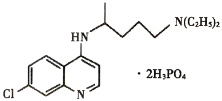
【题目】磷酸氯喹(结构如图所示)在细胞水平上能有效抑制新型冠状病毒的感染,我国印发的《新型冠状病毒肺炎诊疗方案(试行第七版)》中明确规定了其用量。
(1)碳、硅、锗为同一主族元素,则基态硅原子核外电子的空间运动状态有________种,基态锗原子的最外层的电子排布图为__________________。
(2)C、N、O三种元素第一电离能由大到小的顺序是_____________________。
(3)磷酸氯喹分子中氮原子的杂化方式为________,苯环中含有的共价键类型是________。
(4)![]() 的空间构型是____________,与
的空间构型是____________,与![]() 互为等电子体的分子是____________(写一种即可)。
互为等电子体的分子是____________(写一种即可)。
(5)由C、H、O元素组成的H2O和C2H5OH可以任意比例互溶,其原因是________________。
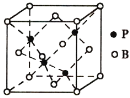
(6)由P与B元素形成的化合物BP的晶胞(如图所示)中B采用面心立方堆积,P原子填入四面体空隙中。已知晶胞边长为a pm,晶体中B原子与P原子的最近距离是___________,设阿伏加德罗常数的值为NA,则BP晶体的密度是___________g/cm3(列出计算表达式)。
【答案】8 ![]() N>O>C sp2、sp3 σ键和π键 正四面体形 CCl4(或SiCl4、SiF4等) H2O与C2H5OH分子之间能形成氢键,并且H2O与C2H5OH均为极性分子
N>O>C sp2、sp3 σ键和π键 正四面体形 CCl4(或SiCl4、SiF4等) H2O与C2H5OH分子之间能形成氢键,并且H2O与C2H5OH均为极性分子 ![]()
![]()
【解析】
(1)硅原子有14个电子,硅原子核外电子排布式为1s22s22p63s23p2,基态锗原子的最外层的电子排布式为4s24p2。
(2)同周期从左到右第一电离能呈增大趋势,但第IIA族大于第IIIA族,第VA族大于第VIA族。
(3)分别分析磷酸氯喹分子中氮的价层电子对数判断杂化方式,苯环中碳原子采取sp2杂化,存在σ键和π键。
(4)计算PO43的价层电子对数,根据价电子数F+= O,C = Si = P+分析等电子体。
(5)溶解性有相似相溶和氢键的影响。
(6)晶体中B原子与P原子的最近距离是体对角线的四分之一,先分析晶胞中B原子和P原子个数,再求BP晶体的密度。
⑴硅原子有14个电子,硅原子核外电子排布式为1s22s22p63s23p2,则基态硅原子核外电子的空间运动状态有8种,基态锗原子的最外层的电子排布式为4s24p2,最外层电子排布图为![]() ;故答案为:8;
;故答案为:8;![]() 。
。
⑵同周期从左到右第一电离能呈增大趋势,但第IIA族大于第IIIA族,第VA族大于第VIA族,因此C、N、O三种元素第一电离能由大到小的顺序是N>O>C;故答案为:N>O>C。
⑶磷酸氯喹分子中 ,标示“2”的氮原子有3个σ键,1对孤对电子,价层电子对数为4,其N的杂化方式为sp3,标示“1”的氮原子有2个σ键,1对孤对电子,价层电子对数为3,其N的杂化方式为sp2,苯环中碳原子采取sp2杂化,存在σ键和π键;故答案为:sp2、sp3;σ键和π键。
,标示“2”的氮原子有3个σ键,1对孤对电子,价层电子对数为4,其N的杂化方式为sp3,标示“1”的氮原子有2个σ键,1对孤对电子,价层电子对数为3,其N的杂化方式为sp2,苯环中碳原子采取sp2杂化,存在σ键和π键;故答案为:sp2、sp3;σ键和π键。
⑷PO43的价层电子对数![]() ,其空间构型是正四面体形,由于F+= O,C = Si = P+,因此与PO43互为等电子体的分子是CCl4(或SiCl4、SiF4等);故答案为:正四面体形;CCl4(或SiCl4、SiF4等)。
,其空间构型是正四面体形,由于F+= O,C = Si = P+,因此与PO43互为等电子体的分子是CCl4(或SiCl4、SiF4等);故答案为:正四面体形;CCl4(或SiCl4、SiF4等)。
⑸由C、H、O元素组成的H2O和C2H5OH可以任意比例互溶,其原因是H2O与C2H5OH均为极性分子,相似相溶原理,H2O与C2H5OH分子之间能形成氢键;故答案为:H2O与C2H5OH分子之间能形成氢键,并且H2O与C2H5OH均为极性分子。
⑹已知晶胞边长为a pm,晶体中B原子与P原子的最近距离是体对角线的四分之一即![]() ,根据分析得到晶胞中B原子个数为
,根据分析得到晶胞中B原子个数为![]() ,P原子个数为4,阿伏加德罗常数的值为NA,则BP晶体的密度是
,P原子个数为4,阿伏加德罗常数的值为NA,则BP晶体的密度是 ;故答案为:
;故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】(1)现有CuO和Fe2O3组成的混合物ag,向其中加入2 molL﹣1的硫酸溶液50 mL,恰好完全反应。若将ag该混合物在足量H2中加热,使其充分反应,计算冷却后剩余固体质量_________。
(2)取一定量的CuO粉末与0.5 L稀硫酸充分反应后,将一根50 g铁棒插入上述溶液中,至铁棒质量不再变化时,铁棒增重0.24 g。并收集到224 mL气体(标准状况)。求此CuO粉末的质量_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 表示阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,22.4L CCl4 含有的原子数为 5NA
B.1.8g 的 NH4+中含有的电子数为 NA
C.常温常压下,32 g O2 和 O3 的混合气体中所含原子数为 1.5 NA
D.7.1g Cl2 溶于水,转移电子数目为 0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定体积的CO2通入NaOH溶液中,向所得的溶液A中逐滴加入1 mol·L-1的稀盐酸,所加盐酸的体积与产生CO2的体积关系如图所示:
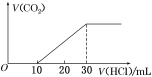
溶液A中的溶质是( )。
A.Na2CO3和NaHCO3B.NaOH和Na2CO3C.Na2CO3D.NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有H+、Mg2+、Al3+三种阳离子,逐滴加入1mol/LNaOH溶液,消耗NaOH溶液体积和生成沉淀之间的关系如图所示,则下列说法正确的是( )
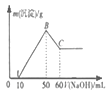
A.横坐标0-50mL时,发生反应只有:Mg2++2OH-═Mg(OH)2↓,Al3++3OH-═Al(OH)3↓
B.B点生成沉淀的物质的量为0.02mol
C.若往C点的溶液中加入0.1mol/L盐酸50mL,沉淀将全部溶解
D.H+、Mg2+、Al3+三种阳离子物质的量浓度之比为2:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() 在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
①增加少量![]() ②升高温度③体积不变,再通入
②升高温度③体积不变,再通入![]() ④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为某种乙醇燃料电池示意图,工作时电子流方向如图所示,下列判断正确的是

A.X为氧气
B.电极A反应式:CH3CH2OH-12e-+3H2O=2CO2+12H+
C.电极材料活泼性:A>B
D.B电极附近溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
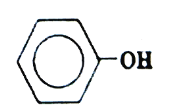
【题目】苯酚(结构简式如图所示),俗称石炭酸。是一种重要的化工原料,广泛用于制适酚醛树脂、染料、医药、农药等。下列说法不正确的是( )
A.分子中所有原子可能共平面
B.固体苯酚分子间可能形成氢键
C.![]() 该分子充分燃烧,会消耗
该分子充分燃烧,会消耗![]()
D.![]() 该分子与足量的氢气加成后,环上的一氯取代物有3种
该分子与足量的氢气加成后,环上的一氯取代物有3种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com