
某研究小组模拟工业处理电镀含氰废水并测定处理的效率,利用下图所示装置进行实验。将CN-的浓度为0.2 mol·L-1的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②三颈烧瓶中,充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。
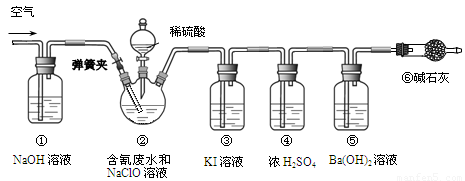
已知装置②中发生的主要反应依次为:CN-+ ClO-=CNO-+ Cl- 2CNO-+2H+ +3C1O-=N2↑+2CO2↑+3C1-+H2O
(1)①和⑥的作用是 。
(2)装置②中,生成需由装置③除去的物质的离子方程式为 。
(3)反应结束后,缓缓通入空气的目的是 。
(4)为计算该实验中含氰废水被处理的百分率,需要测定 的质量。
(5)已知CN-的处理效率可高达90%,产生的CO2在标准状况下的体积为 。
(1)排除空气中CO2对实验的干扰(2)ClO-+Cl-+2H+=Cl2↑+H2O(3)使装置内残留的CO2全部进入装置⑤而被吸收(4)装置⑤反应前后的质量或沉淀(5)0.4L
【解析】
试题分析:(1)①和⑥的作用是排除空气中CO2对实验的干扰(2)根据已知条件可知,有氯离子生成,又次氯酸跟有强氧化性,故反应为ClO-+Cl-+2H+=Cl2↑+H2O。(3)使装置内残留的CO2全部进入装置⑤而被吸收(4)通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,则需要测定装置⑤反应前后的质量。(5)由CN-+ ClO-=CNO-+ Cl- 2CNO-+2H+ +3C1O-=N2↑+2CO2↑+3C1-+H2O,又因为n(CN-)=0.2 mol·L-1×0.1L=0.02mol,转化率为90%,根据关系式可知产生的CO2的体积为0.4L
考点:探究物质的组成或测量物质的含量;氯、溴、碘及其化合物的综合应用


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | c(H2SO4)mol.L-1 | V(H2SO4)mL | V(NaClO)mL | 含氯废水的体积mL |
| 1 | 100 | 100 | ||
| 2 | 0.0500 | 100 | 100 | |
| 3 | 0.2000 | 100 | 100 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年云南省玉溪一中高二下学期期末考试化学试卷(带解析) 题型:实验题
(14分)某研究小组模拟工业上以黄铁矿为原料制备硫酸的第一步反应:
4FeS2+11O2 2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
实验步骤:称取研细的样品4.000g放入上图b装置中,然后在空气中进行煅烧。为测定未反应高锰酸钾的量(假设其溶液体积保持不变),实验完成后取出d中溶液10mL置于锥形瓶里,用0.1000mol/L草酸(H2C2O4)标准溶液进行滴定。
(已知:5SO2 + 2KMnO4 + 2H2O ="=" K2SO4 + 2MnSO4 + 2H2SO4 )
请回答下列问题:
(1)称量样品质量能否用托盘天平 (填“能”或“不能”);
(2)装置a的作用是 ;
(3)上述反应结束后,仍需通一段时间的空气,其目的是 ;
(4)滴定时,发生反应的离子方程式为 ,已知滴定管初读数为0.10mL,末读数如上图所示,消耗草酸溶液的体积为 mL;
(5)该样品中FeS2的纯度为 ;
(6)若用下图装置替代上述实验装置d,同样可以达到实验目的的是 。(填编号)
查看答案和解析>>
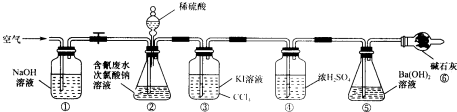
科目:高中化学 来源: 题型:解答题

| 实验 | c(H2SO4)mol.L-1 | V(H2S O4)mL | V(NaClO)mL | 含氯废水的体积mL |
| 1 | ______ | 100 | ______ | 100 |
| 2 | 0.0500 | ______ | 100 | 100 |
| 3 | 0.2000 | ______ | 100 | 100 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com