
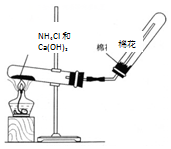
 A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).分析 (1)若A是一种黄色单质固体,则A为S,与氧气反应生成B为SO2,进一步与氧气反应生成C为SO3;
(2)若A是一种活泼金属,C是淡黄色固体,则A为Na、B为Na2O、C为Na2O2,C长期露置于空气中,经过系列变化,最后将变成物质D,D为Na2CO3;
混合物加热,发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,利用差量法计算混合物中碳酸氢钠的质量,进而计算碳酸钠的质量分数;
(3)若C是红棕色气体,实验室用氯化铵和氢氧化钙制备A,则A为NH3,B为NO,C为NO2.
解答 解:(1)若A是一种黄色单质固体,则A是S单质,属于B是二氧化硫,C是三氧化硫,则B→C的化学方程式为2SO2+O2$?_{△}^{催化剂}$2SO3,
故答案为:2SO2+O2$?_{△}^{催化剂}$2SO3;
(2)若A是一种活泼金属,C是淡黄色固体,则A为Na、B为Na2O、C为Na2O2,C长期露置于空气中,经过系列变化,最后将变成物质D,D为Na2CO3,过氧化钠能与CO2反应生成碳酸钠与氧气,反应的化学方程式是2Na2O2+2 CO2=2 Na2CO3+O2↑,
令混合物中碳酸氢钠的质量为m,则:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O 质量减少
168 62
m 10g-9.38g=0.62g
故m=$\frac{168×0.62g}{62}$=1.68g,故碳酸钠的质量分数=$\frac{10g-1.68g}{10g}$×100%=83.2%,
故答案为:2Na2O2+2 CO2=2 Na2CO3+O2↑;Na2CO3;83.2%;
(3)若C是红棕色气体,A可能是一种能使湿润的红色石蕊试纸变蓝的气体,则A为NH3,B为NO,C为NO2,
①氨气在催化作用下可与氧气反应生成NO,方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$NO+6H2O;
②A为氨气,极易溶于水,密度比空气小,可用向下排空气法收集,检验氨气是否收集满,可将湿润的红色石蕊试纸置于试管口处,若试纸变蓝,则证明氨气已收集满,或用白色的酚酞试纸置于试管口处,若试纸变红,则证明氨气已收集满,也可以用蘸有浓盐酸的玻璃棒靠近试管口处,若产生大量白烟,则证明氨气已收集满,
故答案为:将湿润的红色石蕊试纸置于试管口处,若试纸变蓝,则证明氨气已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口处,若产生大量白烟,则证明氨气已收集满);
③工业上用氮气和氢气在高温高压下,催化作用下制备氨气,方程式为N2+3H2 $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,故答案为:N2+3H2 $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;
④二氧化氮和氧气反应生成硝酸,方程式为4NO2+O2+2H2O=4HNO3,由方程式可知1mol二氧化氮与0.25mol氧气反应,故答案为:0.25 mol.
点评 该题考查无机框图题的判断,是高考中的常见题型,属于基础性试题的考查,试题难易适中,侧重对学生基础知识的巩固训练,物质特殊的颜色是推断的突破口


科目:高中化学 来源: 题型:选择题
| A. | 硝酸 | B. | 乙醇 | ||
| C. | 少量硝酸和硝酸银混合溶液 | D. | 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热,然后将气体生成物通入澄清石灰水,观察现象 | |
| B. | 向两种相同浓度的盐溶液中滴入稀盐酸,观察反应的剧烈程度 | |
| C. | 向两种相同浓度的盐溶液中滴入酚酞,观察颜色 | |
| D. | 向两种相同浓度的盐溶液中滴入氢氧化钡溶液,观察现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ | |
| B. | 氢氧化铝与足量盐酸反应 Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠和冷水反应 Na+2H2O═Na++H2↑+OH- | |
| D. | 铜片与稀硝酸反应 Cu+NO3-+4H+═Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下134.4L N2 | B. | 66g CO2 | ||
| C. | 标准状况下90g H2O | D. | 6.02×1024个H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6g Na与足量氧气反应时转移电子的数目一定为0.2NA | |
| B. | 1mol Cl2参加反应时转移的电子数目为2NA | |
| C. | 1mol KClO3中含有的氯离子数目为NA | |
| D. | 22.4L O2中含有2NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
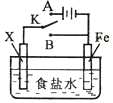
| A. | 若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法 | |
| B. | 若X为铜棒,开关K置于A处,装置中发生的总反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ | |
| C. | 若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红 | |
| D. | 若X为碳棒,开关K置于B处,在铁棒附近滴入硫氰化钾溶液可看到溶液变血红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com