
| A、烧杯、天平、容量瓶、滴管 |
| B、烧杯、量筒、容量瓶、天平 |
| C、量筒、烧杯、容量瓶、滴管 |
| D、量筒、天平、移液管、漏斗 |


科目:高中化学 来源: 题型:
| A、标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5NA |
| B、1 mol乙烷分子含有7NA个共价键 |
| C、58.5 g的氯化钠固体中含有NA个氯化钠分子 |
| D、在1 L 0.1 mol?L-1碳酸钠溶液中,阴离子总数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液做焰色反应,现象为黄色,说明该溶液中不存在K+ |
| B、配制950mL1mol/LNa2CO3溶液时,应用托盘天平称取100.7g无水Na2CO3 |
| C、为证明酸性H2CO3>H2SiO3,可将CO2气体通入Na2SiO3溶液中观察现象 |
| D、用酒精萃取碘水中的I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
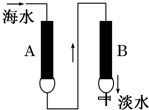 海水的一种淡化方法是使海水(含钠离子、镁离子、氯离子、硫酸根等)依次通过两种离子交换树脂A、B(如图所示),而得到淡化.已知氢型离子交换树脂(HR)可对阳离子进行交换,而羟型离子交换树脂(ROH)可对阴离子进行交换,试分析下列叙述中不正确的是( )
海水的一种淡化方法是使海水(含钠离子、镁离子、氯离子、硫酸根等)依次通过两种离子交换树脂A、B(如图所示),而得到淡化.已知氢型离子交换树脂(HR)可对阳离子进行交换,而羟型离子交换树脂(ROH)可对阴离子进行交换,试分析下列叙述中不正确的是( )| A、HR与镁离子的反应可表示为:2HR+Mg2+═MgR2+2H+ |
| B、ROH与氯离子的反应可表示为:ROH+Cl-═RCl+OH- |
| C、A为氢型离子交换树脂(HR),B为羟型离子交换树脂(ROH) |
| D、A为羟型离子交换树脂(ROH),B为氢型离子交换树脂(HR) |
查看答案和解析>>
科目:高中化学 来源: 题型:

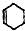 的六元环结构,六元环上只有一个取代基.
的六元环结构,六元环上只有一个取代基.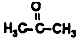 )在一定条件下发生的羟醛缩合反应,该反应除生成假性紫罗兰酮外还生成一个小分子,请写出该反应的化学方程式(不用写反应条件,
)在一定条件下发生的羟醛缩合反应,该反应除生成假性紫罗兰酮外还生成一个小分子,请写出该反应的化学方程式(不用写反应条件, 部分可用R代替).
部分可用R代替).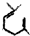 可用R代替).
可用R代替).查看答案和解析>>
科目:高中化学 来源: 题型:
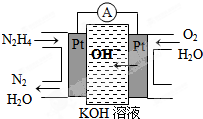

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com