
| A. | 反应停止了 | B. | 正逆反应速率为零 | ||
| C. | 反应物与生成物的浓度一定相等 | D. | 正逆反应速率相等 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;注意化学平衡为动态平衡,反应速率不会等于0.
解答 解:A.化学平衡为动态平衡,反应不会停止,故A错误;
B.化学平衡是动态平衡,当反应达到平衡状态时,正逆反应速率相等,但不为0,故B错误;
C.达到平衡状态时,反应物和生成物的浓度不再变化,但不一定相等,故C错误;
D.达到平衡状态时,正、逆反应的速率一定相等,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
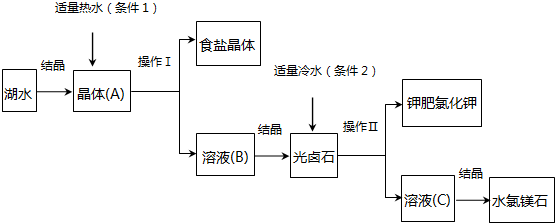
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
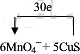
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和环丙烷(C3H6)组成的28g混合气体中含有2 NA个碳原子 | |
| B. | 7.8 g苯中含有0.3NA个碳碳双键,0.3NA个碳碳单键 | |
| C. | 标准状况下,2.24L已烷含有分子的数目为0.1NA | |
| D. | 1molCH4O中含有C-H键的数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素性质呈现周期性的变化的根本原因是核外电子排布呈周期性变化 | |
| B. | 阴阳离子间通过静电引力而形成的化学键叫做离子键 | |
| C. | 凡是含碳元素的化合物都属于有机化合物 | |
| D. | 甲烷化学性质稳定,点燃前不必验纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将2molSO3气体通入一密闭容器中,反应达平衡后吸收QkJ热量,则该反应的热化学方程式为:2SO3(g)?2SO2(g)+O2(g)△H=+Q kJ/mol | |
| B. | 向20mL0.5mol•L-1FeBr2溶液中通入224mL Cl2(标准状况):2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 以金属银为阳极电解饱和硫酸铜溶液 Cu2++2H2O═2Cu+O2↑+4H+ | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液至恰好使SO42-完全沉淀::2Ba2++Al3++2SO42-+4OH-═2H2O+2BaSO4↓+AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3 | |
| B. | 150 mL 1 mol•L-1的氯化钾溶液中的c(Cl-)与50 mL 1 mol•L-1的氯化铝溶液中的c(Cl-)相等 | |
| C. | 20℃时,饱和KCl溶液的密度为1.174 g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl的质量分数为$\frac{74.5×4.0}{1.174×1000}$×100% | |
| D. | 20℃时,100 g水可溶解34.2 g KCl,此时KCl饱和溶液的质量分数为34.2% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com