
分析 (1)根据化合价的变化判断氧化还原反应的相关概念,根据氧化还原反应中氧化剂和还原剂之间得失电子的物质的量相等计算转移电子的物质的量,在氧化还原反应中还原剂的还原性大于还原产物的还原性;
(2)反应中还原剂失电子被氧化,氧化剂得电子被还原,得失电子数目相等;
(3)根据化合价的变化计算转移电子的物质的量,氧化剂的氧化性大于还原剂的氧化性;
(4)根据氧化还原反应中氧化剂和还原剂之间得失电子的物质的量相等计算.
解答 解:(1)a.反应中铜元素化合价从+1价升高到+2价,硫元素化合价从-2价升高到+4价,化合价升高的元素被氧化,所以被氧化的元素有S、Cu,故a正确;
b.锰元素化合价降低,从+7价降低为+2价,Cu2S元素化合价都升高做还原剂,1molMnO4-得到5mol电子,反应中铜元素化合价从+1价升高到+2价,硫元素化合价从-2价升高到+4价,1molCu2S失去8mol电子,则氧化剂与还原剂的物质的量之比为8:5,故b正确;
c.生成2.24LL(标况下)SO2时,物质的量为0.1mol;反应的Cu2S物质的量为0.1mol,反应中转移电子的物质的量是:
Cu+~Cu2+~e-; S2-~SO2~6e-;
1 1 1 6
0.2mol 0.2mol 0.1mol 0.6mol
所以电子转移共0.8mol,故c正确;
d.氧化还原反应中还原剂的还原性大于还原产物的还原性,则还原性的强弱关系是:Mn2+<Cu2S,故d错误.
故选d;
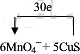
(2)反应②中Mn元素化合价降低,从+7价降低为+2价,1molMnO4-得到5mol电子,CuS中硫元素化合价从-2价升高到+4价,1molCuS失去6mol电子,则二者物质的量之比为6:5,转移电子数目为5×6=30,可表示为 ,故答案为:
,故答案为: ;
;
(3)由H2O2-2e→2H++O2↑可知,反应中若有0.5mol H2O2参加此反应,转移电子的个数为0.5×2×NA=NA,在反应中
MnO4-为氧化剂,H2O2为还原剂,则氧化性MnO4->H2O2,
故答案为:NA;MnO4-;H2O2;
(4)反应2KMnO4+7H2O2+3H2SO4→K2SO4+2MnSO4+6O2↑+10H2O中,2molKMnO4可氧化5molH2O2,生成的6molO2中,有5mol为H2O2被氧化生成,有1mol为H2O2自身发生氧化还原反应生成,则1mol KMnO4氧化的H2O2是2.5mol,故答案为:2.5.
点评 本题综合考查氧化还原反应,题目侧重于氧化还原反应的配平、计算以及氧化性、还原性的比较,易错点为(4),题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 实验①生成HIO3时发生的反应为:I2+5 Cl2+6 H2O=2 HIO3+10 HCl | |
| B. | 实验②中当CCl4层变成红棕色时可通过萃取分液的方法获得Br2的CCl4溶液 | |
| C. | 根据上述实验可得出Cl2、Br2、I2的氧化性由强到弱的顺序是:Cl2>Br2>I2 | |
| D. | 根据上述实验可得出Cl2、HIO3、HBrO3氧化性由强到弱的顺序是:HBrO3>Cl2>HIO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 溴乙烷(乙醇):多次加水振荡,分液,弃水层 | |
| C. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 | |
| D. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2OHCl+HClO K=4.5×10-4.次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2OHCl+HClO K=4.5×10-4.次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨和金刚石不能相互转化 | |
| B. | 金刚石比石墨稳定 | |
| C. | 破坏1mol金刚石中的共价键消耗的能量比石墨多 | |
| D. | 1 mol石墨比1 mol金刚石的总能量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )
将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )| A. | Mg比Al活泼,Mg失去电子被氧化成Mg2+ | |
| B. | 铝条表面虽有氧化膜,但可不必处理 | |
| C. | 该电池的内电路中,阳离子向负极迁移 | |
| D. | Al是电池负极,开始工作时溶液中会立即有白色沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com