
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
分析 1个氨基酸含有1个氮原子,根据氮原子守恒,可知C55H70O19N10,将其完全水解后得到10个氨基酸分子,需要9个水分子,以上四种氨基酸中只有谷氨酸含有4个氧原子,其余三种氨基酸均只含2个氧原子,因此根据氧原子数目守恒进行计算.
解答 解:1个氨基酸含有1个氮原子,根据氮原子守恒,可知C55H70O19N10,将其完全水解后得到10个氨基酸分子,需要9个水分子,以上四种氨基酸中只有谷氨酸含有4个氧原子,其余三种氨基酸均只含2个氧原子,因此根据氧原子数目进行计算,即谷氨酸×4+(10-谷氨酸)×2-9=19,解得谷氨酸数目为4个,故选D.
点评 本题主要考查了蛋白质的水解,抓住水解规律以及谷氨酸的特殊性即可求解,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
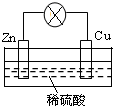
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同质量的CO2(g)和干冰相比较,干冰的能量一定高于CO2(g) | |
| B. | 化学反应过程中能量的变化只可能有吸热和放热两种表现形式 | |
| C. | 同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H相同 | |
| D. | 放热的反应在常温下一定能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磺化、硝化、水化、风化、钝化等都是化学变化 | |
| B. | 干馏、常压分馏、减压分馏都是物理变化 | |
| C. | 甘油不是油,纯碱不是碱,酚醛树脂不是酯,干冰不是冰 | |
| D. | 水煤气、裂解气、焦炉气、天然气都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
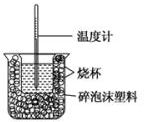 已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题:
已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com