
| A、2NaOH+Cl2=NaCl+NaClO+H2O;Cl2+2OH-=Cl-+ClO-+H2O |
| B、CaCO3+2HCl=CaCl2+CO2↑+H2O;CO32-+2H+=CO2↑+H2O |
| C、Al2(SO4)3+6NH3?H2O=2Al(OH)3↓+3(NH4)2SO4;Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| D、Ba(OH)2+H2SO4=BaSO4↓+2H2O;2H++2OH-=2H2O |


科目:高中化学 来源: 题型:
| A | B | C | D | |
| 强电解质 | NaCl | H2SO4 | CaCO3 | HNO3 |
| 弱电解质 | HF | BaSO4 | HClO | CH3COOH |
| 非电解质 | Cl2 | CS2 | C2H5OH | CaO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2O3→Al(OH)3 |
| B、FeCl3→FeCl2 |
| C、Fe(OH)2→Fe(OH)3 |
| D、、Na2CO3→NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
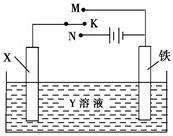
| A、若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法 |
| B、若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀 |
| C、若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D、若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,在18g18O2中含有NA个氧原子 |
| B、标准状况下,17g NH3所含共价键数为NA个 |
| C、标准状况下,22.4L苯的分子数约为NA个 |
| D、1mol Na2O2中含有的阴离子数目为2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com