
【题目】由H、N、O、Al、P组成的微粒中:
(1)微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
①用化学式表示下列4种微粒:
A_________ B___________ C__________ D__________
②写出A、B、E三种微粒反应的离子方程式______________________________。
③用电子式表示B的形成过程_____________________________。
(2)已知白磷(P4)分子、NH4+、N4H44+的空间构型均为四面体,

请画出N4H44+的结构式_____________________。
【答案】 H2O NH3 NH4+ OH- Al3++3NH3+3H2O=Al(OH)3↓+3NH4+ ![]()

【解析】(1)①根据题意,都含有10个电子,B溶于A后所得的物质可电离出C和D,A是H2O,B是NH3,C是NH4+,D是OH-,E是Al3+。
②A、B、E三种微粒反应后可得C和一种白色沉淀,A、B、E三种微粒反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;
③NH3是共价化合物,用电子式表示的形成过程:![]() ;
;
(2)首先根据P4的结构,N4的结构与其相同,此时每个N有三个σ键,和一对孤对电子,因此,N4H44+中每个N与H+形成的是配位键,N提供孤对电子,H+提供空轨道,故其结构式为: 。
。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】对于玻璃器皿上粘有的一些水洗不掉的残留物,其洗涤方法正确的是( )
①残留在试管内壁上的碘,用酒精洗涤
②盛放过苯酚的试剂瓶中残留的苯酚用酒精洗涤
③做银镜反应后试管壁上的银镜,用稀氨水洗涤
④黏附在试管壁上的油脂,用热碱液洗涤.
A.①③④
B.②③④
C.①②④
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下能实现的是( )
①Al2O3 ![]() NaAlO2(aq)
NaAlO2(aq) ![]() Al(OH)3
Al(OH)3
②S ![]() SO3
SO3 ![]() H2SO4
H2SO4
③饱和NaCl(aq) ![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
④Fe2O3 ![]() FeCl2
FeCl2 ![]() 无水FeCl3
无水FeCl3
⑤MaCl2(aq) ![]() Mg(OH)2
Mg(OH)2 ![]() 煅烧MgO.
煅烧MgO.
A.①③⑤
B.②③④
C.②④⑤
D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前人们对环境保护、新能源开发很重视.
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.4CO(g)+2NO2(g)4CO2(g)+N2(g)△H=﹣1200 kJmol﹣1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是(填代号). 
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/mol.L﹣1/时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0~20min的平均反应速率v(CO2)=;计算该反应的平衡常数K= .
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是(填字母代号).
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率(填“升高”或“降低”),△H0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=﹣159.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式 .
(4)一种氨燃料电池,使用的电解质溶液是2mol/L﹣1的KOH溶液.
电池反应为:4NH3+3O2=2N2+6H2O;
请写出通入a气体一极的电极反应式为;每消耗3.4g NH3转移电子的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关Na2CO3和NaHCO3的性质,下列叙述错误的是( )
A.相同温度下,等浓度的Na2CO3和NaHCO3溶液的碱性比较,前者更强
B.常温时水溶性:Na2CO3>NaHCO3
C.在酒精灯加热的条件下,前者不分解,后者分解
D.将澄清的石灰水分别加入Na2CO3和NaHCO3溶液中,前者产生沉淀,后者无现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性, r溶液是一种常见的强酸,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是
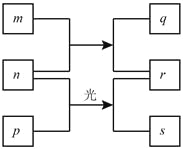
A. 原子半径的大小W<X<Y
B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态
D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯净的氯化锌时,将含杂质的氯化锌溶于过量的盐酸中,为了除去杂质需要调节溶液的pH到4,应加入的试剂是
A.氢氧化钠B.氨水C.氧化锌D.氯化锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 反应中,被氧化的物质是氧化剂
B. 氧化还原反应的本质是电子的转移
C. 某物质的元素在反应中失去电子,则此物质是氧化剂
D. 离子反应可能是复分解反应,但离子反应一定不是氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com