
【题目】理论上讲,任何自发的氧化还原反应都可以设计成原电池![]() 请你利用下列反应“
请你利用下列反应“![]() ”设计一个化学电池,并回答下列问题:
”设计一个化学电池,并回答下列问题:
①该电池的正极材料是 ______ ,负极材料是 ______ ,电解质溶液是 ______。
②在外电路中,电流方向是从 ______ 极到 ______ 极(填“正”或“负”)。
③正极上出现的现象是 ______ .负极上出现的现象是 ______ 。
【答案】Ag或碳棒 Cu AgNO3 正 负 有Ag析出 铜棒变细,溶液显蓝色
【解析】
按照原电池工作原理进行分析,负极上失去电子,化合价升高,发生氧化反应,正极上得到电子,化合价降低,发生还原反应,根据总反应,Cu的化合价升高,即Cu为负极,Ag或碳棒为正极,电解质溶液为AgNO3,电子由负极经外电路流向正极,然后进行分析即可;
①按照原电池工作原理进行分析,负极上失去电子,化合价升高,发生氧化反应,正极上得到电子,化合价降低,发生还原反应,根据总反应,Cu的化合价升高,即Cu为负极,Ag或碳棒为正极,电解质溶液为AgNO3;
②外电路,电子由负极流向正极,则电流方向是由正极向负极移动;
③正极电极式为Ag++e-=Ag,现象是有Ag析出;负极反应式为Cu-2e-=Cu2+,现象是铜棒变细,溶液显蓝色。


科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
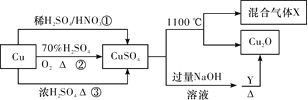
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2
B. 相对于途径①、③,途径②更好地体现了绿色化学思想
C. 1 mol CuSO4在1100 ℃所得混合气体X中O2为0.75 mol
D. Y可以是葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 标准状况下,22.4LCHCl3含有的分子数目为NA
B. 3.4g羟基(-OH)含有2NA个电子
C. 1L0.1mol/L甘氨酸( )溶液中含有的氧原子数为0.2NA
)溶液中含有的氧原子数为0.2NA
D. 0.5molC4H10中含有的非极性共价键数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是一种常用的食品抗氧化剂(易被氧化)。实验室利用如图所示装置制取少量焦亚硫 酸钠,并探究 SO2 的性质 (夹持装置已略去)。

请回答下列问题:(实验前已除去装置中的空气)
(1)仪器 a 的名称是_____。
(2)关闭 K2、K3,打开 K1,装置 B 中发生反应的离子方程式为_________,观察到装 置 C 中发生的现象是_____。
(3)装置 D 和 F 的作用是____。
(4)实验前,E 中所用蒸馏水需经煮沸后迅速冷却,目的是_____, 关闭 K1、K3,打开 K2,一段时间后 E 中有 Na2S2O5 晶体析出,装置 E 中发生反应的化学方程式为__________________。
(5)设计实验验证 Na2S2O5 晶体在空气中已被氧化,所需试剂为_____。
(6)在测定某葡萄酒中Na2S2O5 残留量时,取 40.00 mL 葡萄酒样品,加入指示剂,用 0.01000 mol·L1 的碘标准液滴 定,当溶液_________,即为终点。测定实验中,消耗碘标准液 10.00 mL,该样品中Na2S2O5的残留量为_____g·L1(以 SO2 计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物 H 可用于光刻工艺中,作抗腐蚀涂层。下列是高聚物 H 的一种合成路线:


已知:①D 属于高分子化合物;
请回答下列问题:
(1)A 的化学名称为 ____。
(2)B 中含氧官能团的名称是 ____。
(3)由 A 生成 B 和 Y 生成 E 的反应类型分别为_________ 。
(4)由 F 生成 G 的化学方程式为_____ 。
(5)H 的结构简式为_____。
(6)只有一种官能团的芳香化合物 W 是 G 的同分异构体,W 能发生银镜反应,其中核磁共振氢谱为四组峰,峰面积 比为 3∶2∶2∶1 的结构简式为_____。
(7)参照上述合成路线,设计由对二甲苯和乙酸为原料制备 ![]() 的合成路线(无机 试剂任选) ____。
的合成路线(无机 试剂任选) ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。

请回答下列问题:
(1)指出反应的类型:A→C:_________________;
(2)在A~E五种物质中,互为同分异构体的是________________(填代号);
(3)写出由A生成B的化学方程式:_____________________________;
(4)写出D与NaOH溶液共热反应的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶炼金属一般有下列4种方法:①焦炭法;②水煤气法(或氢气、或一氧化碳)法;③活泼金属置换法;④电解法。4种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。对它们的冶炼方法的分析不正确的是
A. (Ⅰ)用① B. (Ⅱ)用② C. (Ⅲ)用③ D. (Ⅳ)用④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来环境问题突出,大气污染更为严重。回答下面问题
(1)下列选项中属于重点城市空气质量日报首要污染物的是_____
A.CO2 B.SO2 C.可吸入颗粒物 D.H2S
(2)汽车尾气常含有CO、NO等有毒气体,汽车气缸中生成NO的化学方程式是___________
(3)汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,反应机理如下(以Pt催化剂为例)
I:NO+Pt(S)=NO(S)(Pt(S)表示催化剂,NO(S)表示吸附态NO,下同)
II:CO+Pt(S)=CO(S)
III:NO(S)=N(S)+O(S)
IV:CO(S)+O(S)=CO2+2Pt(S)
V:N(S)+N(S)=N2+2Pt(S)
VI:NO(S)+N(S)=N2O+2Pt(S)
尾气中反应物及生成物浓度随温度的变化关系如下图。

回答下面问题
①汽车尾气消污反应最适宜的反应温度是____
A. 250℃ B.300℃ C.330℃ D.400℃
②330℃以下的低温区发生的主要反应的化学方程式是___________
③低温区N2O选择性高于N2,由此可推断出:V反应的活化能____Ⅵ反应的活化能(填
“<”、“>”或“=”),理由是_______________
④结合反应机理和图像温度位于330℃—400℃时,升高温度,V反应的反应速率_____,(填“增大”、“减小”或“不变”,下同),Ⅳ反应的反应速率__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com