
【题目】下列反应过程能量变化如下所示:H2(g)+Cl2(g)===2HCl(g) ΔH
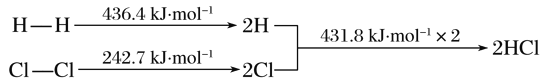
下列说法错误的是( )
A. H—H键比Cl—Cl键稳定
B. 正反应活化能比逆反应活化能高
C. ΔH=-184.5 kJ·mol-1
D. 在相同条件下,1 mol H2(g)和1 mol Cl2(g)分别在点燃和光照条件下反应生成2 mol HCl(g),重新恢复到原来的状态时ΔH相同
 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是
A | B | C | D |
|
|
|
|
钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀 | 钢铁表面水膜的酸性较强,发生析氢腐蚀 | 将锌板换成铜板对钢闸门保护效果更好 | 钢闸门作为阴极而受到保护 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应过程中的能量变化如图所示,下列说法错误的是( )

A. 反应体系中加入催化剂,不会改变反应的热效应
B. 反应物的总能量高于生成物的总能量
C. 该反应的热化学方程式为3H2+N2![]() 2NH3 ΔH=Q(Q>0)
2NH3 ΔH=Q(Q>0)
D. 该反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。 |
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| Ⅰ | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_________;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是_________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究对O2氧化性的_________影响。
③实验Ⅳ中加入Na2SO4溶液的目的是_________。
④为达到丁同学的目的,经讨论,同学们认为应改用右图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是_________;重复实验时,记录电压表读数依次为c′、d′,且c′>d′,由此得出的结论是_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品。
(1)CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)![]() COCl2(g) ΔH =a kJ/mol反应过程中测定的部分数据如下表:
COCl2(g) ΔH =a kJ/mol反应过程中测定的部分数据如下表:

①反应0~2min末的平均速率v(COCl2)=_______mol/(L·min)。
②在2min~4min间,v(Cl2)正______v(Cl2)逆 (填“>”、“=”或“<”), 该温度下K =_______L/ mol。
③已知X、L可分别代表温度或压强,如图表示L一定时,CO的转化率随X的变化关系。
X代表的物理量是__________;a_________0 (填“>”,“=”,“<”)。

(2)在催化剂作用下NO和CO转化为无毒气体:
2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) ΔH=-748 kJ·mol-1
2CO2(g)+N2(g) ΔH=-748 kJ·mol-1
①一定条件下,单位时间内不同温度下测定的NO转化率如图1所示。温度高于710K时,随温度的升高NO转化率降低的原因可能是____________________。
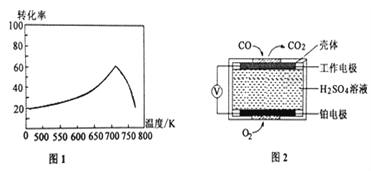
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为________________;方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式______________________。
(3)一定条件下,将CO和H2充入2L密闭容器中反应,可生成甲醚(CH3OCH3)。
4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H<0
CH3OCH3(g)+H2O(g) △H<0
下列能判断反应达到平衡的是_______________。
A.υ(H2)=2υ(CO) B.容器内的压强不变
C.混合气体的密度不变 D.混合气体的平均相对分子质量不变
E.甲醚的浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系互为同分异构体的是( )
A.35C1和37ClB.CH3CH2CH2 CH3和CH(CH3)3
C.CH3CH3和CH3CH2CH3D.H2O和H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y均为元素周期表ⅦA族中的两种元素。下列叙述中,能够说明X的原子得电子能力比Y强的是
A. 原子的电子层数:X>Y
B. 对应的简单离子的还原性:X>Y
C. 气态氢化物的稳定性:X>Y
D. 氧化物对应水化物的酸性:X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,则下列说法错误的是
A. Y和Z可以组成元素质量比为7:16的化合物
B. X和Y可以组成原子个数比分别为3:l和2:l的两种化合物
C. 由X、Y、Z三种元素中任意两种组成的具有10电子的微粒多于2种
D. X、Y、Z只能组成一种盐,其中X、Y、Z原子个数比为4:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将某X气体V L溶于水中,得到12mol·L-1的溶液500mL,则气体的体积V是( )
A.134.4L B.67.2L C.44.8L D.537.6L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com