
【题目】某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。 |
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| Ⅰ | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_________;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是_________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究对O2氧化性的_________影响。
③实验Ⅳ中加入Na2SO4溶液的目的是_________。
④为达到丁同学的目的,经讨论,同学们认为应改用右图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是_________;重复实验时,记录电压表读数依次为c′、d′,且c′>d′,由此得出的结论是_________。

【答案】(1)①2H+ + 2e- = H2↑;②在金属活动性顺序中,Cu在H后,Cu不能置换出H2;O2 + 4H+ + 4e- = 2H2O
(2)①O2浓度越大,其氧化性越强,使电压值增大;②溶液的酸碱性;③排除溶液中的Na+(或SO42-)对实验的可能干扰;④排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响;溶液酸性越强,O2的氧化性越强(介质或环境的pH影响物质的氧化性)
【解析】
试题分析:(1)①Ⅰ中铁主要发生了析氢腐蚀,其正极发生还原反应,电极反应式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②铜与氢离子不能发生自发的氧化还原反应;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极发生还原反应,氧气得电子生成氢氧根离子,其正极的电极反应式是O2+4H++4e-=2H2O,故答案为:在金属活动性顺序中,Cu在H后,Cu不能置换出H2;O2+4H++4e-=2H2O;
(2)①实验Ⅱ、Ⅲ、Ⅳ的电解质相同,不同的是氧气的浓度不同,出现了电压表读数不同,根据数值的相对大小可知,氧气浓度越大,电压表的读数越高,所以O2浓度越大,其氧化性越强,使电压值增大,故答案为:O2浓度越大,其氧化性越强,使电压值增大;
②实验Ⅳ、Ⅴ是溶液的酸碱性不同,来判断电压表的指针偏转情况,所以Ⅳ、Ⅴ进行比较,其目的是探究对O2氧化性的酸碱性的影响,故答案为:溶液的酸碱性;
③实验Ⅳ中加入Na2SO4溶液的目的是排除溶液中的Na+(或SO42-)对实验的可能干扰,故答案为:排除溶液中的Na+(或SO42-)对实验的可能干扰;
④为达到丁同学的目的,经讨论,同学们认为应改用如图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响;重复实验时,记录电压表读数依次为c′、d′,且c′>d′,由此得出的结论是溶液酸性越强,O2的氧化性越强,故答案为:排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响;溶液酸性越强,O2的氧化性越强(介质或环境的pH影响物质的氧化性)。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1mol MaHSO4熔化或溶于水时电离出来的离子总数均为3NA
B. 0.1 mol NO和0.1 molO2充分反应,转移的电子数目为0.2NA
C. 常温下,1 L pH=2的CH3COOH溶液中含有的氢原子数目小于0.1NA
D. 100g质量分数为46%的乙醇溶液中含有的氢原子数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中,可制得Cl2的正确组合是( )
①MnO2和浓盐酸混合共热 ②MnO2、NaCl和浓硫酸混合共热 ③NaClO和浓盐酸混合 ④K2Cr2O7和浓盐酸混合 ⑤KClO3和浓盐酸混合共热 ⑥KMnO4和浓盐酸混合
A. ①②⑥ B. ②④⑥
C. ①④⑥ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种细菌在酸性水溶液中,有氧气的情况下,可以将黄铜矿(主要成分是CuFe![]() ,含少量杂质SiO2)氧化为硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下:
,含少量杂质SiO2)氧化为硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下:
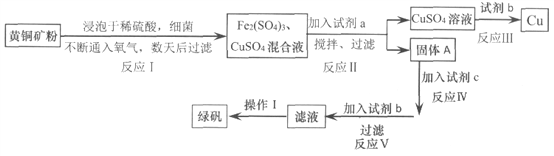
已知:
Fe2+ | Cu2+ | Fe3+ | |
开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
回答下列问题:
(1)试剂a是_________,调节溶液的pH值,为使Fe3+完全沉淀,合适pH的范围是_______。
(2)试剂b为________,请写出反应III的离子方程式________________。
(3)固体A成份是________。
(4)欲从滤液中获得绿矾晶体,操作I应为________________、洗涤干燥。
(5)反应I中参加反应的n(CuFeS2):n(O2)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰锌铁氧体可用于隐形飞机上吸收雷达波涂料。现以废旧锌锰电池为原料制备锰锌铁氧体的主要流程如下:

(1)碱性锌锰干电池(电解质为 KOH)中 MnO2参与反应的电极反应式为______________________。
(2)用硫酸酸浸时,为了提高浸取率可采取的措施有________________________(任写一点)。酸浸时,二氧化锰被双氧水还原的化学方程式为___________________。
(3)活性铁粉除汞时,铁粉的作用是______________ (填“氧化剂” 或“还原剂” 或“吸附剂” ) 。
(4)除汞是以氮气为载气吹入滤液带出汞蒸汽经 KMnO4溶液进行吸收而实现的。 在不同pH下,KMnO4溶液对Hg的吸收率的影响及主要产物如图所示。

①请根据该图给出 pH对汞吸收率影响的变化规律: __________________________。
②试分析在强酸性环境下 Hg 的单位时间吸收率高的原因可能是: _______________。
(5)经测定滤液成分后同时加入一定量的 MnSO4和铁粉的目的是________________。
(6)当 x=0.2 时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该铁氧体组成_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液蒸干后,能析出溶质固体的是( )
①FeCl3 ②Fe2(SO4)3 ③Ca(HCO3)2 ④Na2CO3
A.仅①④ B.仅②④
C.仅①② D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程能量变化如下所示:H2(g)+Cl2(g)===2HCl(g) ΔH
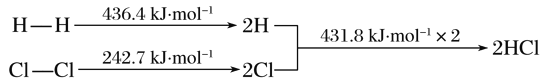
下列说法错误的是( )
A. H—H键比Cl—Cl键稳定
B. 正反应活化能比逆反应活化能高
C. ΔH=-184.5 kJ·mol-1
D. 在相同条件下,1 mol H2(g)和1 mol Cl2(g)分别在点燃和光照条件下反应生成2 mol HCl(g),重新恢复到原来的状态时ΔH相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿斯巴甜(F)是一种广泛应用于食品、饮料、糖果的甜味剂,其结构式为 ,合成阿斯巴甜的一种合成路线如下:
,合成阿斯巴甜的一种合成路线如下:

已知:①芳香族化合物A能发生银镜反应,核磁共振氢谱显示有5 种不同化学环境的氢。
②
③RCN ![]() RCOOH
RCOOH
④
回答下列问题:
(1)A 的名称为_________,E含有的官能团是_____________。
(2)反应①的类型是_________,反应⑤的类型是__________。
(3)C和D的结构简式分别是_______、_________。
(4)C的同分异构体中能同时满足下列条件的共有________种(不考虑立体异构)。
①苯环上有两个取代基
②能与FeCl3 溶液作用显紫色
③能与饱和NaHCO3 溶液反应产生气体
(5)参照上述合成路线,设计一条由甲醛为起始原料制备氨基乙酸的合成路线:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17种元素。稀土元素有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,位于周期表的_____区,基态原子价电子排布图为_______。
(2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有_______。
(3)Sm(钐)的单质与l,2-二碘乙烷可发生如下反应:Sm +ICH2CH2I→SmI2+CH2=CH2。
ICH2CH2I中碳原子杂化轨道类型为______, lmol CH2=CH2中含有的σ键数目为______。常温下l,2-二碘乙烷为液体而乙烷为气体,其主要原因是__________。
(4) PrO2(二氧化镨)的晶体结构与CaF2相似,晶饱中Pr(镨)原子位于面心和顶点。则PrO2(二氧化镨)的晶胞中有________个氧原子。
(5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516pm。晶胞中Ce(铈)原子的配位数为_______,列式表示Ce(铈)单质的密度:________g/cm3(用NA表示阿伏伽德罗常数的值,不必计算出结果)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com