
����Ŀ������ʮ�����Ǿ��иߴ����ܶȵ��������壬������ʮ������C10H18������������C10H12��������C10H8��������������ͷ���������֪��
C10H18(l)![]() C10H12(l)��3H2(g) ��H1
C10H12(l)��3H2(g) ��H1
C10H12(l)![]() C10H8(l)��2H2(g) ��H2
C10H8(l)��2H2(g) ��H2
��H1����H2��0��C10H18��C10H12�Ļ��ΪEa1��C10H12��C10H8�Ļ��ΪEa2��ʮ�����ij�ѹ�е�Ϊ192������192����Һ̬ʮ���������ⷴӦ��ƽ��ת����ԼΪ9������ش�
��1�����������������Ӧƽ��ת���ʵ�������_________��
A�����¸�ѹ B�����µ�ѹ C�����µ�ѹ D�����¸�ѹ
��2���о���������������ʮ�������ں����ܱշ�Ӧ���У������¶ȴ�����ѹ����������Ҳ���������⣬������______________________________________________________��
��3���¶�335�����ں����ܱշ�Ӧ���н��и�ѹҺ̬ʮ������1.00 mol��������ʵ�飬���C10H12��C10H8�IJ���x1��x2�������ʵ��������ƣ���ʱ��仯��ϵ����ͼ1��ʾ��
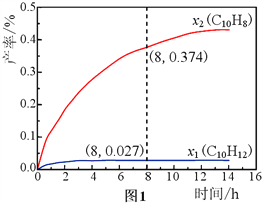

����8 hʱ����Ӧ��ϵ����������Ϊ__________mol��������������Ӧ����
��x1��������x2��ԭ����________________________________________��
����ͼ2�л�����C10H18��C10H12��C10H8��������������Ӧ������ʾ��ͼ��
������ѧ�ҷ��֣���H2O��N2Ϊԭ�ϣ�����NaOH��KOHΪ����ʣ�����Fe2O3����������250���ͳ�ѹ�¿�ʵ�ֵ绯ѧ�ϳɰ��������������ı仯����Ϊ���������У��벹��������
��4���缫��Ӧʽ��________________________________��2Fe��3H2O��N2��Fe2O3��2NH3��
���𰸡� C ��Ӧ���ȣ��¶����ߣ�ƽ�������ƶ������ͬʱ���¶����ߵ���ʮ����������Ũ������ƽ�������ƶ��������������������� ��1.951���ڷ�Ӧ2�Ļ�ܱȷ�Ӧ1С����ͬ�¶��·�Ӧ2���죬������ͬʱ���ڣ����ɵ��������ֶ�ת��Ϊ������x1��������x2.  Fe2O3+6e-+3H2O=2Fe+6OH
Fe2O3+6e-+3H2O=2Fe+6OH
������������(1)C10H18(l)![]() C10H12(l)��3H2(g) ��H1��C10H12(l)
C10H12(l)��3H2(g) ��H1��C10H12(l)![]() C10H8(l)��2H2(g) ��H2����H1����H2��0����Ϊ���ȷ�Ӧ���Ҷ�������������ʵ�������ķ�Ӧ��
C10H8(l)��2H2(g) ��H2����H1����H2��0����Ϊ���ȷ�Ӧ���Ҷ�������������ʵ�������ķ�Ӧ��
A�������¶ȣ�ƽ�������ƶ���ƽ��ת������������ѹǿ��ƽ�������ƶ���ƽ��ת���ʼ�С����A����B�������¶ȣ�ƽ�������ƶ���ƽ��ת���ʼ�С����B����C�������¶ȣ�ƽ�������ƶ���ƽ��ת��������Сѹǿ��ƽ�������ƶ���ƽ��ת��������C��ȷ��D�������¶ȣ�ƽ�������ƶ���ƽ��ת���ʼ�С����D����ѡC��
(2)�ܷ�ӦΪ�÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���ƽ��ת��������ƽ�ⳣ�������¶ȴﵽ192��ʱ��ʮ����������Ũ������ƽ�������ƶ��������������������ӣ��ʴ�Ϊ����Ӧ���ȣ��¶����ߣ�ƽ�������ƶ������ͬʱ���¶����ߵ���ʮ����������Ũ������ƽ�������ƶ��������������������ӣ�
(3)���¶�335�棬��8 hʱ��ʮ����Ϊ1.00 mol�����C10H12��C10H8�IJ���x1=0.027��x2=0.374��������C10H12��C10H8�����ʵ����ֱ�Ϊ0.027mol��0.374mol���跴Ӧ��C10H18�����ʵ���Ϊa����ӦC10H12�����ʵ���Ϊb�����ݷ�Ӧ
C10H18(l)![]() C10H12(l)��3H2(g)
C10H12(l)��3H2(g)
1 1 3
a a 3a
C10H12(l)![]() C10H8(l)��2H2(g)��
C10H8(l)��2H2(g)��
1 1 2
b b 2b
��a-b=0.027��b=0.374����a=0.401��������ɵ����������ʵ�������Ϊ3a+2b=3��0.401+2��0.374=1.951������������Ϊ1.951mol���ʴ�Ϊ��1.951��
�ڷ�Ӧ2�Ļ�ܱȷ�Ӧ1С����ͬ�¶��·�Ӧ2���죬������ͬʱ���ڣ����ɵ��������ֶ�ת��Ϊ������x1��������x2���ʴ�Ϊ����Ӧ2�Ļ�ܱȷ�Ӧ1С����ͬ�¶��·�Ӧ2���죬������ͬʱ���ڣ����ɵ��������ֶ�ת��Ϊ������x1��������x2��
��C10H18(l)![]() C10H12(l)��3H2(g) ��H1��C10H12(l)
C10H12(l)��3H2(g) ��H1��C10H12(l)![]() C10H8(l)��2H2(g) ��H2����H1����H2��0��������Ӧ��Ϊ���ȷ�Ӧ������������������ڷ�Ӧ���C10H18��C10H12��C10H8��������������Ӧ������ ʾ��ͼΪ
C10H8(l)��2H2(g) ��H2����H1����H2��0��������Ӧ��Ϊ���ȷ�Ӧ������������������ڷ�Ӧ���C10H18��C10H12��C10H8��������������Ӧ������ ʾ��ͼΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
����(4)��H2O��N2Ϊԭ�ϣ�����NaOH��KOHΪ����ʣ�����Fe2O3����������250��ͳ�ѹ�¿�ʵ�ֵ绯ѧ�ϳɰ���������������ԭ��Ӧ��������һ����Ӧ2Fe��3H2O��N2��Fe2O3��2NH3����֪��Fe2O3������������ת��Ϊ������˵缫��ӦʽΪFe2O3+6e-+3H2O=2Fe+6OH-���ʴ�Ϊ��Fe2O3+6e-+3H2O=2Fe+6OH-��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������������ܱ������з������·�Ӧ:mA(g)+nB(g) ![]() pC(g),�ﵽƽ����¶Ȳ��䣬���������ѹ����1/2�����ﵽƽ��ʱC��Ũ��Ϊԭ����1.9����������������ȷ����( )
pC(g),�ﵽƽ����¶Ȳ��䣬���������ѹ����1/2�����ﵽƽ��ʱC��Ũ��Ϊԭ����1.9����������������ȷ����( )
A. m+n��p B. A��ת��������
C. ƽ�����淴Ӧ�����ƶ� D. C�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ���DZ�ʾ����һ�������ᷴӦʱ������������֮�����ʵ�����mol���Ĺ�ϵ��������ȷ���ǣ� ��
A.
B.
C.
D.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴ӦA��g��+ 2B(g)![]() 2C(g)(����Ӧ����)������ͼ������ȷ���ǣ� ��
2C(g)(����Ӧ����)������ͼ������ȷ���ǣ� ��
A.  B.
B. 
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ������H2A��HA-��A2-����ˮ��Һ��ϵ�У�H2A��HA-��A2- �����и�����ռ�����ʵ�����������������ҺpH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
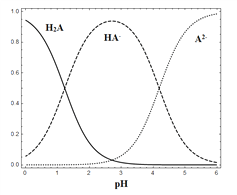
A. �ں�H2A��HA-��A2- ����Һ�У���������NaOH���壬����HA-��һ������
B. �������ʵ�����NaHA��Na2A���������ˮ�����õ���Һ������HA-��=����A2-��
C. NaHA��Һ�У�HA-��ˮ������С��HA-�ĵ�������
D. �ں�H2A��HA-��A2-����Һ�У���c(H2A)+2c(A2-)+c(OH-)=c(H+)��������H2A��������HA-��һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ļ۵����Ų��У���һ��������С��ԭ�ӿ����ǣ� ��
A.ns2np3B.ns2np5C.ns2np4D.ns2np6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�ֻҪ������һ���������Ժ��ֱ�����ϣ���ȫȼ�գ����ɵĶ�����̼��ˮ������Ҳ���Ƕ�ֵ��(����)
A. ��������� B. �������ϩ
C. �������ϩ D. ��ϩ�ͱ�ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¶Ȳ���������£��ں��ݵ������н������з�Ӧ��N2O4��g���T2NO2��g������N2O4��Ũ����0.1molL��1����0.07molL��1��Ҫ15s����ôN2O4��Ũ����0.07molL��1����0.05molL��1����ķ�Ӧʱ�䣨 ��
A.����5s
B.����10s
C.��10s
D.����10s
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��50ml0.50molL��1������50mL0.55molL��1NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���� �зų��������ɼ����к��ȣ��ش��������⣺ 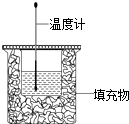
��1����ʵ��װ���Ͽ���ͼ��ȱ�ٵ������� ��
��2��ʵ��������70mL0.50molL��1�����70mL0.55molL��1NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų������������ȡ�����ȡ����������к��������ȡ�����ȡ�����
��3����50ml0.25molL��1H2SO4�������ᣬ��50mL0.275molL��1Ba��OH��2���� NaOH��Һ��������ʵ�飬��õ��к��ȵľ���ֵ�����ƫ��ƫС������Ӱ�족����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com