
某元素R的原子的质量数为70,其核内中子数为39,它的离子有28个电子,则此元素的氧化物的化学式应为
A.RO B.R2O3 C.RO2 D.R2O5
科目:高中化学 来源: 题型:
下列变化中,属于放热反应的是
A.H2O(g)==H2O(l) △H= -44kJ/mol
B.2HI(g)==H2(g)+I2(g) △H=+14.9kJ/mol
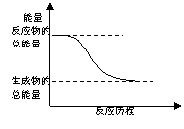
C.能量变化如右图所示的化学反应
D.形成化学键时放出能量的化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于Na2CO3和NaHCO3性质的说法错误的是( )
A.热稳定性:NaHCO3<Na2CO3
B.与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3
C.相同温度时,在水中的溶解性:NaHCO3<Na2CO3
D.等物质的量浓度溶液的pH:NaHCO3<Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
在Na2SO4、NaCl、NaOH的混合溶液中,含有Na+、SO42-、OH-的个数比是8:1:2,则溶液中Na2SO4、NaCl、NaOH的物质的量之比是( )
A.1:1:1 B.1:4:2 C.1:2:4 D.1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
H-是负一价的阴离子,它可与NH3发生以下反应:H-+NH3= H2+NH2-,下列有关这个反应的说法中不正确的是
A. 该反应中NH3被还原 B.该反应中H-是还原剂
C.该反应中NH2-是还原产物 D.反应中被氧化和被还原的元素都是H元素
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液450 mL.根据这两种溶液的配制情况回答下列问题:

(1) 根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 ____ mL(计算结果保留一位小数,下同)。
(2)如图所示的仪器中配制溶液肯定不需要的是 (填序号),仪器C的名称是 ,本实验所需玻璃仪器E的名称为
(3)在配制NaOH溶液实验中,其他操作均正确。若定容时仰视刻度线,则所配制溶液浓度 ______0.1 mol/L(填“大于”“等于”或“小于”,下同)。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度__ 0.1 mol/L。
(4) 下列操作不正确的是 (填序号)。[]
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线
E.定容时不小心水加多了少许,立即用胶头滴管吸出即可
 F.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
F.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(5)右图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
①将________升氯化氢(标准状况)通入1.00L水中可得到36.5﹪的浓盐酸,该浓盐酸中HCl的物质的量浓度为
②取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
CO是对环境影响较大的气体,对它的合理控制和治理是优化我们生存环境的有效途径。
(1)工业上用CO和H2做原料可以合成甲醇,作为液体燃料。已知:
① 2H2(g)+CO(g)+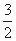 O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
② 2CH3OH(l)+3O2(g) = 4H2O(g)+2CO2(g) ΔH2 = -1452kJ/mol
请写出用CO(g)和H2(g)合成1mol液态甲醇的热化学反应方程式:___________。
(2)一定温度下,在容积为2L的恒容容器中加入3mol H2和2mol CO,当反应2H2(g)+CO(g)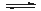 CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的
CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的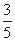 ,据此计算该温度下反应的平衡常数(写过程)。
,据此计算该温度下反应的平衡常数(写过程)。
(3)在恒温恒容的条件下,向(2)达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则平衡 。
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.无法判断是否移动
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
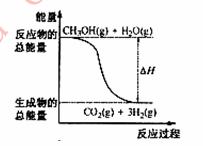
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH= + 49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
下列说法正确的是( )
A.CH3OH的燃烧热为192.9 kJ/mol
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g) ΔH > -192.9kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com