
【题目】在如图所示的恒温、恒压密闭容器中加入2mol X和2mol Y,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?) ![]() a Z(g)。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:
a Z(g)。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:

(1)a = _________________;
(2)平衡时Y的转化率=________________
(3)X的状态为______________,Y的状态为______________(填“气态”或“非气态”)
(4)下列叙述中,能说明上述反应达到平衡状态的是____________(填编号)
a.气体密度不变 b.单位时间内消耗2mol X,同时生成amol Z
c.Y的转化率不再变化 d.Z的浓度不再变化
e.气体的质量不随时间的变化而变化
【答案】1 40% 非气态 气态 acde
【解析】
可以利用三段式解答。
假设消耗的Y的物质的量为x,则消耗的X的物质的量为3x,生成的Z的物质的量为ax:
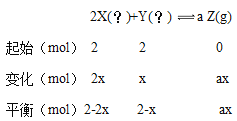
由于达到平衡时X、Y、Z的物质的量之比为1:3:2,所以有![]() ,
,![]() ,解出x=0.8,a=1。
,解出x=0.8,a=1。
(1)a =1;
(2)平衡时Y的转化率=![]() 。
。
(3)反应开始时的体积和平衡后的体积相等,说明反应前后气体系数之和相等。a=1,所以X为非气态,Y为气态。故答案为:非气态,气态。
(4)a.气体密度等于气体的总质量除以容器的体积,由于该反应有非气体参加,所以气体总质量在未平衡前是变化的,但容器体积不变,所以气体密度在未平衡前是一变量,平衡后密度才不变,可以用气体密度不变判断反应达到平衡状态;
b.单位时间内消耗2mol X,同时生成amol Z,都是正向反应,并没有指明正逆反应速率相等,故不能判断反应是否平衡;
c.当反应物的转化率不再变化时,说明反应达到了平衡状态;
d.某气体物质的浓度不再变化,可以证明反应达到了平衡状态;
e.由于该反应有非气体参加,所以气体总质量在未平衡前是变化的,所以当气体的质量不随时间的变化而变化时反应即达到了平衡状态。
故选acde。


科目:高中化学 来源: 题型:
【题目】根据下列实验:
①向Fe2(SO4)3和CuSO4的混合液中加入过量铁粉,充分反应,有红色固体析出,过滤。
②取①中滤液,向其中滴加KSCN溶液,观察现象。
判断下列说法正确的是
A. 氧化性Cu2+>Fe3+
B. ①中所得固体只含铜
C. ①中滤液含有Cu2+和Fe2+
D. ②中不会观察到溶液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸溶液是常用的消毒剂、漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
(查阅资料)
资料1:常温常压下,Cl2O为棕黄色气体,沸点为 3.8 ℃,42 ℃以上会分解生成 Cl2和O2, Cl2O易溶于水并与水立即反应生成 HClO。
资料2:将氯气和空气(不参与反应)按体积比 1∶3 混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O![]() Cl2O+2NaCl+2NaHCO3,用水吸收 Cl2O(不含Cl2)制得次氯酸溶液。
Cl2O+2NaCl+2NaHCO3,用水吸收 Cl2O(不含Cl2)制得次氯酸溶液。
(装置及实验)用以下装置制备次氯酸溶液

回答下列问题:
(1)各装置的连接顺序为_____→_____→_____→____→E。
(2)装置 A 中反应的离子方程式是______。
(3)装置 E中反应的化学方程式是_____。
(4)装置 B 中多孔球泡和搅拌棒的作用是_______;反应过程中,装置B需放在冷水中,其目的是_____。
(5)装置 C 的主要作用是_____。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)_____。
(7)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸与金属反应时,浓度越稀还原产物价态越低。现用一定量的铝粉与镁粉组成的混合物与100mL硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,向反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与产生的沉淀质量的关系如图所示。
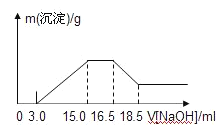
下列结论正确的是
A.铝与混合溶液反应的离子方程式为8Al+3OH-+3NO3-→8Al3++3NH4++9H2O
B.参加反应硝酸根离子物质的量为0.06 mol
C.参加反应的铝与镁的质量之比为4︰3
D.混合液中硫酸的物质的量的浓度为0.36 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3 mol NH3分子中所含原子数与________个H2O分子中所含原子数相等。
(2)0.1 mol/L Al2(SO4)3溶液100mL与0.3mol/LK2SO4溶液200mL混合,则所得溶液中硫酸根离子的物质的量浓度为__________。(混合后,忽略体积变化)
(3)相同质量的SO2、SO3的氧原子的个数之比为____,体积比_______。
(4)液态化合物在一定量的氧气中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)=XO2(g)+2YO2(g)冷却后,在标准状况下测得生成物的体积是336mL,密度是2.56g/L.
①反应前O2的体积是_____mL(标准状况),化合物XY2的摩尔质量是_____.
②若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为_____和_____(写元素符号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种天然药物桥环分子合成的部分路线图(反应条件已经略去):
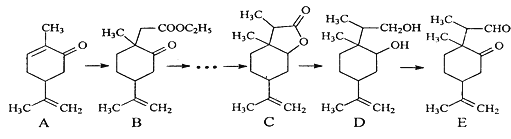
已知:①LiBH4可将醛、酮、酯类还原成醇,但不能还原羧酸、羧酸盐、碳碳双键;LiBH4遇酸易分解。
②RCH2COOR' ![]() RCH(CH3)COOR',RCOR'
RCH(CH3)COOR',RCOR' ![]() RCH(OH)R',RCOOR'
RCH(OH)R',RCOOR' ![]() RCH2OH+R'OH。
RCH2OH+R'OH。
(1)反应A→B中需要加入试剂X,其分子式为C4H8O2,X的结构简式为_____。
(2)C用LiBH4还原得到D,C→D不直接用镍作催化剂H2还原的原因是______。
(3)写出一种满足下列条件的A的同分异构体的结构简式为_____________。①属于芳香族化合物;②能使FeCl3溶液显色;③分子中有4种不同化学环境的氢。
(4)写出E和银氨溶液反应的化学方程式_________。
(5)根据已有知识并结合相关信息,设计B→C的合成路线图(CH3I和无机试剂任选),合成路线常用的表示方式为:![]() 。____________
。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔在不同条件下可以转化成许多化合物,如图,下列叙述错误的是( )
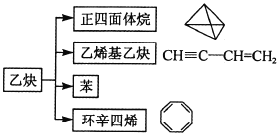
A. 正四面体烷的一氯代物及二氯代物均只有1种
B. 乙炔生成乙烯基乙炔是加成反应
C. ![]() 与环辛四烯(C8H8)互为同分异构体
与环辛四烯(C8H8)互为同分异构体
D. 等质量的苯与乙烯基乙炔完全燃烧时的耗氧量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
化学键 | 键能kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
下列说法正确的是
A. 该反应为吸热反应B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1D. 生成1 mol NH3放出92 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列反应:
①2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
②CaO+H2O=Ca(OH)2
③Ba(OH)2+H2SO4=BaSO4↓+2H2O
④Zn+2HCl=ZnCl2+H2↑
⑤2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
⑥CaCO3![]() CaO+CO2↑
CaO+CO2↑
⑦2CO+O2![]() 2CO2
2CO2
⑧SO42-+Ba2+=BaSO4↓
(1)既是分解反应又是氧化还原反应的是_____,既是化合反应又是氧化还原反应的是______(均填序号)。
(2)请用单向桥表示反应①的电子转移的方向和数目:________________。其中,该反应的氧化产物是___________,还原产物是__________。
(3)反应③的离子反应方程式为_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com