
【题目】有下列反应:
①2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
②CaO+H2O=Ca(OH)2
③Ba(OH)2+H2SO4=BaSO4↓+2H2O
④Zn+2HCl=ZnCl2+H2↑
⑤2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
⑥CaCO3![]() CaO+CO2↑
CaO+CO2↑
⑦2CO+O2![]() 2CO2
2CO2
⑧SO42-+Ba2+=BaSO4↓
(1)既是分解反应又是氧化还原反应的是_____,既是化合反应又是氧化还原反应的是______(均填序号)。
(2)请用单向桥表示反应①的电子转移的方向和数目:________________。其中,该反应的氧化产物是___________,还原产物是__________。
(3)反应③的离子反应方程式为_________________________________________。
【答案】⑤ ⑦ 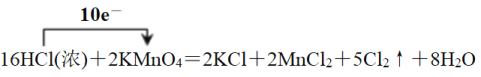 Cl2 MnCl2 Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
Cl2 MnCl2 Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
【解析】
(1)反应前后有元素化合价升降的反应是氧化还原反应,由一种物质生成两种或两种以上物质的反应是分解反应,由两种或两种以上物质生成一种物质的反应是化合反应,则
①2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中Mn和Cl元素化合价变化,是氧化还原反应,但不是化合反应,也不是分解反应;
②CaO+H2O=Ca(OH)2中元素化合价均不变,不是氧化还原反应,属于化合反应;
③Ba(OH)2+H2SO4=BaSO4↓+2H2O是复分解反应,不是氧化还原反应;
④Zn+2HCl=ZnCl2+H2↑中Zn和H的化合价变化,是氧化还原反应,但属于置换反应;
⑤2KClO3![]() 2KCl+3O2↑中Cl和O的化合价变化,是氧化还原反应,属于分解反应;
2KCl+3O2↑中Cl和O的化合价变化,是氧化还原反应,属于分解反应;
⑥CaCO3![]() CaO+CO2↑中元素化合价均不变,不是氧化还原反应,属于分解反应;
CaO+CO2↑中元素化合价均不变,不是氧化还原反应,属于分解反应;
⑦2CO+O2![]() 2CO2中C和O的化合价变化,是氧化还原反应,属于化合反应;
2CO2中C和O的化合价变化,是氧化还原反应,属于化合反应;
⑧SO42-+Ba2+=BaSO4↓中元素化合价均不变,不是氧化还原反应,属于复分解反应;
因此既是分解反应又是氧化还原反应的是⑤,既是化合反应又是氧化还原反应的是⑦。
(2)反应①中Mn从+7价降低到+2价得到5个电子,Cl从-1价升高到0价失去1个电子,则根据电子得失守恒可知用单向桥表示反应①的电子转移的方向和数目为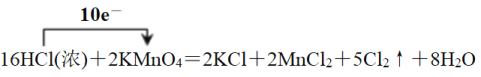 。其中,该反应的氧化产物是Cl2,还原产物是MnCl2。
。其中,该反应的氧化产物是Cl2,还原产物是MnCl2。
(3)反应Ba(OH)2+H2SO4=BaSO4↓+2H2O的离子反应方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O。


科目:高中化学 来源: 题型:
【题目】新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池。 磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
【方法一】 将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
【方法二】 将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其他产物均以气体逸出。
【方法三】 以铁红、锂辉石LiAl (SiO3)2 (含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如下:
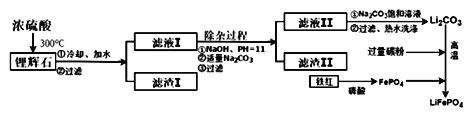
己知: 2LiAl (SiO3) 2+ H2SO4(浓)=Li2SO4+ Al2O3·4SiO2·H2O↓
溶解度/℃ | 20 | 40 | 60 | 80 |
溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
溶解度(Li2SO4) /g | 34.2 | 32.8 | 31.9 | 30.5 |
(1) 在方法一中,阳极生成磷酸亚铁锂的电极反应式为______________________________。
(2)在方法二中,除生成磷酸亚铁锂、乙酸外,还有H2O、________(填化学式)生成。
(3)方法一与方法二中,制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是________________。
(4)在方法三中从滤渣I中可分离出Al2O3,如下图所示。请写出生成沉淀的离子方程式________________。
![]()
(5)向滤液II中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是___________________________。(6) 写出在高温下生成磷酸亚铁锂的化学方程式______________________________________。
(7)磷酸铁锂锋动力电池(简称LFP) 是一种高效、超长寿命的二次电池。其工作原理为:
C6Li+FePO4![]() C6Li(1-x)+ (1-x) FePO4+xLiFePO4充电时,写出阴极反应方程式____________________。
C6Li(1-x)+ (1-x) FePO4+xLiFePO4充电时,写出阴极反应方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是 ( )
A. 在NaClO和NaCl的混合溶液中,Ag+、K+、NO3-、I-可以大量共存
B. Kw/C(H+) =1×10-13mol·L-1的溶液中: NH4+、Ca2+、Cl-、NO3-
C. ![]() 在溶液中能大量共存,通过量
在溶液中能大量共存,通过量![]() 后仍能大量共存
后仍能大量共存
D. 水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、Al![]() 、C
、C![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A. C3H8中碳原子都采用的是sp3杂化
B. O2、CO2、N2都是非极性分子
C. 酸性:H2CO3<H3PO4<H2SO4<HClO
D. CO的一种等电子体为NO+,它的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素在生物体内含量虽少,却是生命活动不可缺少的,可通过下面哪些实例得到证明( )
A. Mg2+是叶绿素的组成成分 B. 缺N会影响蛋白质的合成
C. 哺乳动物血液中Ca2+的含量太低会出现抽搐 D. 油菜缺少硼,会只开花不结果
查看答案和解析>>
科目:高中化学 来源: 题型:
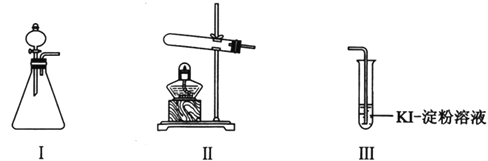
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向I的锥形瓶中加入______,.向I的______中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是__________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列________溶液(填序号),证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeCl2 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)________________________造成的,请设计实验证明他们的猜想是否正确________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有CaCl2、MgCl2、Na2SO4以及泥沙等杂质,以下是制备精盐的实验方案,步骤如图:
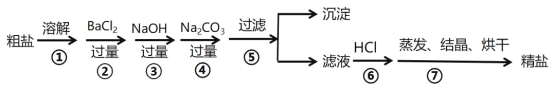
(1)在第①步粗盐溶解操作中要用到玻璃棒搅拌,其目的是_________________;
(2)第②步操作的目的是除去粗盐中的______________;( 填化学式,下同)
(3)第④步操作的目的是除去粗盐中的_____________、______________;,写出相应的离子反应方程式:_______________________;_________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能的开发与利用是能源领域的一个重要研究方向,由CO2制取C的太阳能工艺如图所示,下列有关说法正确的是( )

A. 分解1molFe3O4转移电子数为2NA
B. 根据盖斯定律可知,△H1+△H2=0
C. FeO在CO2转化为C的过程中的作用是催化剂
D. 该工艺是将太阳能转化为电能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com