
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.2 g H218O与D216O的混合物中所含中子、电子数目均为NA
B.8.96L氢气、一氧化碳的混合气体完全燃烧,消耗氧分子的数目为0.2NA
C.100 mL 1.0 mol·L-1 FeCl3溶液与足量Cu反应,转移的电子数为0.2NA
D.pH=1的H2SO4溶液10 L,含H+的数目为2NA
【答案】A
【解析】
此题考查物质的量的基本公式的应用,根据反应,分子,溶液中的关系进行解题,注意细微之处。
A. 根据公式n=![]() 得出物质的量,再根据分子和电子的物质的量之间的关系解得答案。两种分子的中子数和电子数均为10,且其摩尔质量均为20g/mol,故2 g H218O与D216O的混合物中所含中子、电子数目均为NA,故A正确,符合题意。
得出物质的量,再根据分子和电子的物质的量之间的关系解得答案。两种分子的中子数和电子数均为10,且其摩尔质量均为20g/mol,故2 g H218O与D216O的混合物中所含中子、电子数目均为NA,故A正确,符合题意。
B. “8.96L氢气、一氧化碳的混合气体完全燃烧”,没有指明气体的温度和压强,无法计算其耗氧量,故B不正确,不符合题意。
C. 100 mL 1.0 mol·L-1 FeCl3溶液与足量Cu反应,根据方程式解得转移的电子数为0.1NA,故C不正确,不符合题意。
D. pH=1的H2SO4溶液10 L,根据pH的计算公式,含H+的数目为NA,故D不正确,不符合题意。
故答案为:A。


科目:高中化学 来源: 题型:
【题目】已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的 物质的量浓度的负对数与溶液的pH的变化悄况如图所示。
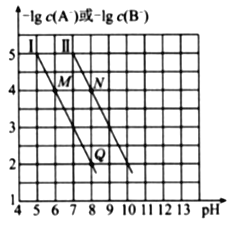
下列说法正确的是( )
A. 曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B. ![]()
C. 溶液中水的电离程度:M>N
D. N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法不正确的是( )

A. 元素乙的原子序数为32
B. 原子半径比较:甲>乙>Si
C. 元素乙的简单气态氢化物的稳定性强于![]() 。
。
D. 推测乙可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含如下离子组中的几种![]()
![]()
![]()
![]() ,某同学欲探究该溶液的组成进行了如下实验:
,某同学欲探究该溶液的组成进行了如下实验:
Ⅰ.用铂丝醮取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,此时溶液颜色加深,但无沉淀生成
Ⅲ.取Ⅱ反应后溶液分别置于两支试管中,第一支试管中加入 BaCl2 溶液有白色沉淀生成, 再滴加 KSCN 溶液,上层清液变红,第二支试管加入 CCl4,充分振荡静置后溶液分层,下层为无色。
下列说法正确的是( )
A.原溶液中肯定不含 ![]()
B.原溶液中肯定含有 ![]()
C.步骤Ⅱ中无色气体是 NO 气体,无 CO2 气体产生
D.为确定是否含有 Cl-可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学给分子式为C12H26的某烷烃命名为“2,4-二甲基-3,5-二乙基己烷”,另一同学认为这样命名有错误,有关该烷烃的说法,你认为正确的是
A. 若该烷烃由单烯烃与氢气加成而得,则原单烯烃可有11种不同结构
B. 该烷烃的一氯代物有10种
C. 该烷烃正确名称应为2,4,5-三甲基-3-乙基庚烷
D. 该烷烃分子中含有5个支链
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3X(g)+Y(g) ![]() Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
(1)升高温度:____________;
(2)增大压强:____________;
(3)增大容器容积:______________;
(4)加入X:______________;
(5)加入Y:______________;
(6)压缩体积:______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳氢化合物有多种,它们在工业生产、生活中有重要用途。
(1)工业上可由丁烯(C4H8)来制备丙烯(C3H6)和乙烯(C2H4),其主要反应原理为:
反应I:C4H8 (g) ![]()
![]() C3H6(g) ΔH1
C3H6(g) ΔH1
反应II:C4H8(g) ![]() 2C2H4 (g) ΔH2
2C2H4 (g) ΔH2
①已知烃的裂解是吸热反应,则ΔH1________ΔH2(填“>”、 “=”或“<”)。
②若某温度下反应达到平衡时C4H8、C3H6、C2H4的体积分数分别为20%、70%、10%,平衡时总压强为P,请计算该温度下反应II的平衡常数Kp=________(Kp为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)
(2)石油危机日渐严重,甲烷的转化和利用在天然气化工行业有非常重要的作用。甲烷重整技术主要是利用甲烷和其他原料来制备合成气(CO和H2混合气体)。现在常见的重整技术有甲烷-水蒸气重整,甲烷-二氧化碳重整,其反应分别为:
CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0
CH4(g) + CO2(g) ![]() 2CO(g) + 2H2(g)
2CO(g) + 2H2(g)
①下图为反应压强为0.3 MPa,投料比n(H2O)/n(CH4)为1,在三种不同催化剂催化作用下,甲烷-水蒸气重整反应中CH4转化率随温度变化的关系。
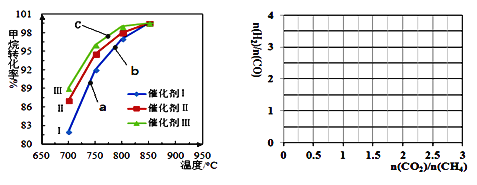
下列说法正确的是________。
A 在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ
B b点CH4的转化率高于a点,原因是b、a两点均未达到平衡状态,b点温度高,反应速率较快,故CH4的转化率较大
C C点一定未达到平衡状态
D 催化剂只改变反应速率不改变平衡移动,所以在850℃时,不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CH4的转化率相同
②催化剂Ⅰ也可以催化甲烷-二氧化碳重整。在催化剂Ⅰ催化下,反应温度850 oC ,n(H2O)/n(CH4)为1的体系中,加入CO2。画出反应达到平衡时n(H2)/n(CO)随进料时n(CO2)/n(CH4)的变化曲线。(已知:甲烷-二氧化碳重整的平衡常数>>甲烷-水蒸气重整反应的平衡常数)________ 。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。
①阳极的电极反应式为________。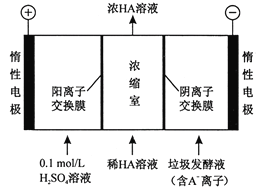
②电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。400 mL10 g/L 乳酸溶液通电一段时间后,浓度上升为 145 g/L(溶液体积变化忽略不计),则阴极上产生的H2在标准状况下的体积约为________L。(乳酸的摩尔质量为90g/ mol )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、A1O2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是
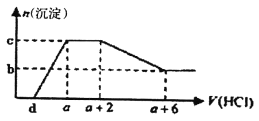
A. 原溶液中可能含有Na2SO4、可能不含有CO32-
B. 原溶液中一定含有的阴离子只有:OH-、A1O2-、CO32-
C. 原溶液中含CO32-与A1O2-的物质的量之比为3:4
D. a-d>3/4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是
A. 3g 3He含有的中子数为1NA
B. 1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C. 1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D. 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com