
【题目】某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种,取该溶液进行连续实验,实验内容如下: 
根据以上信息,回答下列问题:
(1)反应③的化学方程式为 .
(2)沉淀C,H和气体F的化学式分别为 .
(3)写出有关反应的离子方程式:①中生成A . ⑤ .
(4)上述离子中,溶液X中肯定不含有的离子是 , 可能含有的离子是 .
【答案】
(1)4NO2+O2+2H2O=4HNO3
(2)BaSO4、Fe(OH)3、NH3
(3)3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O;AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣
(4)Ba2+、CO32﹣、SO32﹣、NO3﹣;Fe3+、Cl﹣
【解析】解:在强酸性溶液中一定不会存在CO32﹣和SO32﹣离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42﹣离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2 , E为HNO3 , 说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,沉淀H为Fe(OH)3 , 生成气体F,则F为NH3 , 说明溶液中含有NH4+离子,溶液G中通入CO2气体,生成沉淀I,则I为Al(OH)3 , G为NaOH和NaAlO2 , 说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3﹣离子,含有SO42﹣离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl﹣ . (1)由以上推断可知,D为NO2 , E为HNO3 , 反应③的化学方程式为:4NO2+O2+2H2O=4HNO3 , 所以答案是:4NO2+O2+2H2O=4HNO3;(2)由以上推断可知,沉淀C为BaSO4沉淀,沉淀H为Fe(OH)3 , 气体F为NH3 , 所以答案是:BaSO4、Fe(OH)3、NH3;(3)①Fe2+离子被氧化为Fe3+离子,NO3﹣离子被还原为NO气体,反应的离子方程式为3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O,所以答案是:3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O;②G为NaOH和NaAlO2混合物,通入过量二氧化碳后分别发生的反应为:CO2+OH﹣=HCO3﹣ , AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣ , 所以答案是:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣ . (4)通过以上分析可知,X中肯定含有:Al3+、NH4+、Fe2+、SO42﹣;可能含有Fe3+、Cl﹣;一定没有:Ba2+、CO32﹣、SO32﹣、NO3﹣;所以答案是:Ba2+、CO32﹣、SO32﹣、NO3﹣;Fe3+、Cl﹣ .


科目:高中化学 来源: 题型:
【题目】下列描述中,不正确的是
A. 硅胶是用二氧化硅和水反应制得的
B. 水泥是以黏土和石灰石为原料制成的
C. 普通玻璃是以纯碱、石灰石和石英砂为原料制成的
D. 赏心悦目的雕花玻璃是用氢氟酸对玻璃刻蚀而成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,已知:1molCH4完全燃烧时放出980kJ的热量,1molH2完全燃烧时放出280kJ的热量,现有CH4和H2组成的混合气体共0.4mol,使其在O2中完全燃烧,恢复至常温共放出252kJ的热量,则 CH4与H2的物质的量之比是 ( )
A. 1︰1B. 1︰2C. 2︰3D. 3︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:苯和卤代烃在催化剂的作用下可以生成烷基苯和卤化氢,A是水果的催熟剂,C是生活中常见的有机物,乙苯能被酸性高锰酸钾溶液氧化为苯甲酸.几种物质之间的转化关系如图所示(生成物中所有无机物均已略去). 
请回答下列问题:
(1)写出物质的结构简式:A、C、E .
(2)在①~⑥6个反应中,属于消去反应的是(填编号).
(3)写出下列反应的化学方程式:
①;
②;
⑥ .
H→I反应方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国药学家屠呦呦荣获2015年诺贝尔生理学或医学奖,成为首位获得诺贝尔科学类奖项的中国人。获奖理由是她发现了抗疟新药--青蒿素。青蒿素的分子是为C15H22O5 , 常温下是一种无色针状晶片。下列有关说法正确的是( )
屠呦呦领奖图
A.青蒿素属于无机化合物
B.青蒿素属于氧化物
C.标准状况下,1mol青蒿素的体积约为22.4L
D.青蒿素的摩尔质量为282g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化关系如图所示,反应过程中部分产物可能已略去。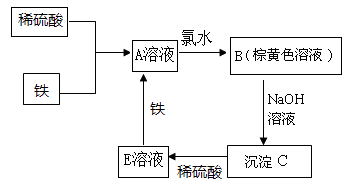
请回答以下问题:
(1)E溶液中溶质的化学式为。若将沉淀C加热至恒重,最终得到的物质是。
(2)A溶液中滴加入NaOH溶液,振荡,放置一段时间,可以观察到的现象是 , 发生反应的化学方程式有。
(3)若在酸性的A溶液中通入氧气,也能得到棕黄色溶液,请写出此反应的离子方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的用途、贯穿古今.
(1)水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用图表达.试写出有水参加的符合反应类型Ⅳ的一个化学方程式: , 其中水为剂.
(2)过氧化氢的水溶液俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.关于双氧水,回答下列问题:
①下列反应中,H2O2既体现氧化性又体现还原性的反应是
A.Na2O2+2HCl═2NaCl+H2O2
B.Ag2O+H2O2═2Ag+O2↑+H2O
C.2H2O2═2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH═K2CrO4+3K2SO4+8H2O
②保存过氧化氢的试剂瓶上最适合贴上的一个标签是(填序号)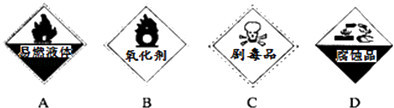
(3)焊接铜器时,可先用NH4Cl 除去其表面的氧化铜再进行焊接,该反应可表示为:
4CuO+2NH4Cl ![]() 3Cu+CuCl2+N2↑+4H2O
3Cu+CuCl2+N2↑+4H2O
①用双线桥标明电子转移的方向和数目. .
②该反应中,被氧化的元素是 , 氧化剂是 .
③还原剂与氧化产物的物质的量之比为 .
④反应中若产生0.2mol的氮气,则有mol的电子转移.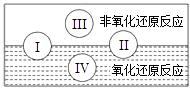
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 非金属氧化物都是酸性氧化物 B. 金属氧化物都是碱性氧化物
C. 氧气与臭氧属于同素异形体 D. 氧化物都可以直接和水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃ 时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( ) 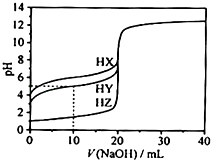
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10﹣5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X﹣)>c(Y﹣)>c(OH﹣)>c(H+)
D.HY与HZ混合,达到平衡时:c(H+)═ ![]() +c(Z﹣)+c(OH﹣)
+c(Z﹣)+c(OH﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com