
| 0.1×2-0.1×1 |
| 2+1 |
| 0.1 |
| 3 |
| 0.1 |
| 3 |


科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L H2O的分子数为1 NA |
| B、物质的量浓度为0.5 mol?L-1的MgCl2溶液,含有Cl-数为1 NA |
| C、64 g SO2中含有的氧原子数为1NA |
| D、常温常压下,14 g N2含有分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是同一浓度的不同表示方法 |
| B、数值不同,也能换算为相同值 |
| C、不同浓度的两种硝酸溶液 |
| D、无法比较其大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 400℃ |
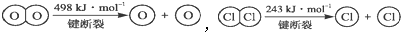 ,断开1molH-O键与断开1mol H-Cl键所需能量相差约为
,断开1molH-O键与断开1mol H-Cl键所需能量相差约为查看答案和解析>>
科目:高中化学 来源: 题型:
 W、Q、R、X、Y、Z六种元素的原子序数逐渐增大.已知W原子Is轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为(n+1)sn(n+1)pn.请回答下列问题:
W、Q、R、X、Y、Z六种元素的原子序数逐渐增大.已知W原子Is轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为(n+1)sn(n+1)pn.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
A、 制备并收集乙炔 |
B、 除去乙醇中溶有的少量乙酸 |
C、 制备少量乙酸乙酯 |
D、 石油的分馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.查看答案和解析>>
科目:高中化学 来源: 题型:
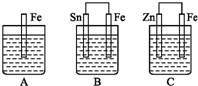 A,、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示:
A,、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一支钢笔使用两种不同牌号的墨水,易出现堵塞 |
| B、向FeCl3溶液中加入NaOH溶液,出现红褐色沉淀 |
| C、医疗上常用血液透析治疗由肾功能衰竭等疾病引起的尿毒症 |
| D、江河入海处,易形成沙洲 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com