
【题目】可逆反应C(s)+H2O(g)H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如图. 
①图中t2到t3段、t4到t6段时引起平衡移动的条件分别可能是、;
②图中表示平衡混合物中CO的含量最高的一段时间是 .
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】下列对于实验I~IV的说法正确的是( ) 
A.实验I:逐滴滴加盐酸时,试管中立即产生大量气泡
B.实验Ⅱ:可比较氯、碳、硅三种元素的非金属性强弱
C.实验Ⅲ:从饱和食盐水中提取NaCl晶体
D.装置Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在2L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:下列说法正确的是( )
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(molL﹣1) | 0.44 | 0.6 | 0.6 |
A.a=1.64
B.此时刻正反应速率大于逆反应速率
C.若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大
D.若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( ) 
A.31d和33d属于同种核素
B.气态氢化物的稳定性:a>d>e
C.工业上常用电解法制备单质b和c
D.a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的是( )
实验目的 | 实验操作 | |
A | 配制1.0mol/L CuSO4溶液 | 把25g胆矾晶体溶于水配成100mL溶液 |
B | 证明某溶液中含有SO42﹣ | 向该溶液中滴入BaCl2溶液 |
C | 实验室制大量CO2 | 向稀硫酸中加入大理石 |
D | 制备Fe(OH)3胶体 | 将饱和的FeCl3溶液滴加到热NaOH溶液中 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是 ( )
A. 由共价键形成的物质一定是共价化合物
B. 只有金属元素和非金属元素化合时才能形成离子键
C. 分子中不一定存在化学键
D. 共价化合物可能含离子键,离子化合物可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法没有科学性错误的是
A.“白雪牌”漂白精可令所有有色物质黯然失“色”,没有最白,只有更白
B.液态氯化氢是100%的盐酸,其H+浓度极大
C.氯元素有毒,禁入口中
D.CaCl2具有吸水性和潮解性,夏日里用CaCl2的水溶液喷洒柏油路,可有效保护路面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业.从切割废料中回收银并制备铜化工产品的工艺如图: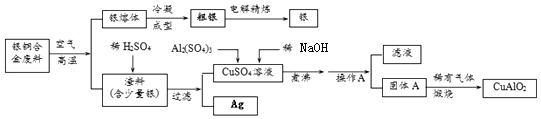
(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式: .
(2)固体混合物A的组成为、 .
(3)操作A的名称为 .
(4)若银铜合金中铜的质量分数为64%,理论上5.0kg废料中的铜可完全转化为mol CuAlO2 , 至少需要1.0molL﹣1的Al2(SO4)3溶液 L.
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是、、过滤、干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏伽德罗常数的值.下列说法不正确的是( )
A.12g金刚石中平均含有2NA个σ键
B.1molSiO2晶体中平均含有4NA个σ键
C.12g石墨中平均含1.5NA个σ键
D.1molCH4中含4NA个s﹣pσ键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com