
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
ⅠA | 0 | ||||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | B | ① | ② | Ne | |||||
3 | ③ | ④ | ⑤ | Si | ⑥ | ⑦ | |||
(1) ①的元素符号是__________
(2) ②和⑥两种元素的原子半径大小关系:_________(填“>”或“<”);
(3) ③和⑤两种元素的金属性强弱关系:________(填“>”或“<”);
(4)③和⑦形成的化合物属于_________(填“离子化合物”或“共价化合物”);写出该化合物的电子式为:______________________;
(5)写出元素②在周期表中的位置_______________________;
(6)④的单质与⑥的最高价氧化物对应的水化物的稀溶液反应的离子方程式:_____________。
【答案】N < > 离子化合物 ![]() 第二周期VIA族 Mg+2H+=Mg2++H2↑
第二周期VIA族 Mg+2H+=Mg2++H2↑
【解析】
根据元素在周期表的位置可知,①为N元素,②为O元素,③为Na元素,④为Mg元素,⑤为Al元素,⑥为S元素,⑦为Cl元素,根据元素周期律和物质的结构与性质作答。
根据上述分析可知,
(1) ①的元素符号是N;
(2) 同一主族,元素原子半径从上到下依次增大,则②和⑥两种元素的原子半径大小关系为:②<⑥;
(3) 同一周期元素的金属性从左到右依次减弱,则③和⑤两种元素的金属性强弱关系:③>⑤;
(4)③和⑦形成的化合物为氯化钠,属于离子化合物,由钠离子与氯离子构成,其电子式为:![]() ;
;
(5)元素②在周期表中的位置为第二周期VIA族;
(6)④的单质为Mg,⑥的最高价氧化物对应的水化物的稀溶液为稀硫酸,则两者反应的离子方程式:Mg+2H+=Mg2++H2↑。


科目:高中化学 来源: 题型:
【题目】下列说法中,在科学上没有错误的是( )
A.吸带过滤嘴的香烟,对人体无害
B.利用气球内的干冰释放出二氧化碳的原理,使气球始终处于充足了气的状态
C.纯天然物质配成的饮料,不含任何化学物质
D.蒸馏水绝对纯净,其中不含任何离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸在下列转化中,既表现出氧化性又表现出酸性的是 ( )
A. Cu―→CuSO4 B. C―→CO2
C. Fe(OH)3―→Fe2(SO4)3 D. Fe2O3―→Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要产物之一,其产量常用于衡量一个石油化工发展水平的标志。下列是有机物A~G之间的转化关系:

请回答下列问题:
(1)A的官能团的名称是____________。C的结构简式是____________。
(2)E是一种具有香味的液体,由B + D→的反应方程式为:____________。该反应类型是____________。
(3)G是一种高分子化合物,其名称是____________,链节是____________。
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质F(沸点12.27OC)进行应急处理。写出由A制F的化学反应方程式:____________。决定F能用于冷冻麻醉应急处理的性质是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按下图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)下列说法中正确的是__(填序号).
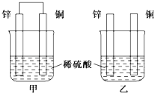
A.甲、乙均为化学能转变为电能的装置
B.甲中铜为正极,乙中铜为负极
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中的pH值均增大
(2)在相同时间内,两烧杯中产生气泡的速率:甲__乙(填“>”、“<”或“=”).
(3)写出甲池中负极反应的电极反应式为:_______________________________。
(4)当甲中产生3.36L(标准状况)气体时,理论上通过导线的电子数目为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能与盐酸反应又能与氢氧化钠溶液反应的是( )
A. Al(OH)3 B. Fe(OH)3 C. Mg(OH)2 D. Cu(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如下图(甲不一定在丁、庚的连线上),戊、己分别 是空气、地壳中含量最多的元素。下列判断正确的是
![]()
A. 甲一定是金属元素
B. 庚的最高价氧化物水化物酸性最强
C. 乙、丙、丁的最高价氧化物水化物可以以相互反应
D. 气态氢化物的稳定性:庚>己>戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)普鲁士蓝的化学式为Fe4[Fe(CN)6]3,该物质中存在的化学键有离子键、_______和_______;含有的Fe3+的核外电子样布式为_______________。
(2)KCN 可被H2O2 氧化为KOCN
①KOCN 可作为制药原料,其晶体类型是__________;碳原子采取sp杂化,1mol该物质中含有的π键数目为___________。含有的三种非金属元素的电负性由大到小的顺序是________。(2)H2O2常温下是液体,沸点较高(150℃),其主要原因是____________。
(3)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如下左图,As 原子的杂化方式为____,雌黄和SnCl2 在盐酸中反应转化为雌黄(As4S4) 和SnCl4,SnCl4 分子的空间构型为_______。
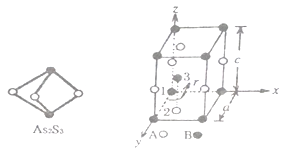
(4)某晶体的晶胞结构如上右图所示,该晶体的化学式为______________,该晶胞参数分别为apm,cpm,γ=120°如图示;1号原子坐标为(0,0,0),2 号原子坐标为(1/3,2/3,0),则3号原子坐标为____________,计算上述晶体中A和B 两原子间的最小核间距为________pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com