
 .
.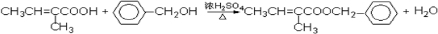 .
. 、
、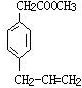 、
、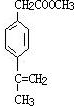 .
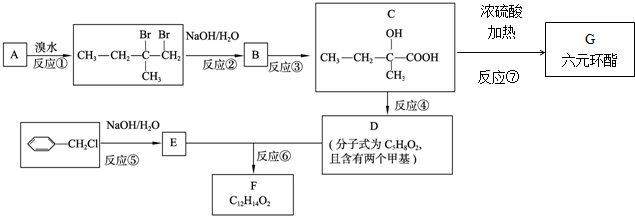
. 分析 根据A和溴水的加成产物可判断A为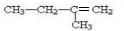 ,反应②是卤代烃的水解反应,生成物B为
,反应②是卤代烃的水解反应,生成物B为 ;B发生氧化反应得到C(
;B发生氧化反应得到C( ),由C、D的分子式可知,C发生消去反应生成D,且D分子中含有2个甲基,故D为
),由C、D的分子式可知,C发生消去反应生成D,且D分子中含有2个甲基,故D为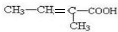 ,D在浓硫酸存在条件下发生酯化反应生成六元环酯G,则G的结构简式为
,D在浓硫酸存在条件下发生酯化反应生成六元环酯G,则G的结构简式为 ;反应⑤属于卤代烃的水解反应,则E的结构简式为
;反应⑤属于卤代烃的水解反应,则E的结构简式为 ,E和D发生酯化反应生成F,则F的结构简式为
,E和D发生酯化反应生成F,则F的结构简式为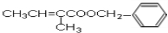 ,据此进行解答.
,据此进行解答.
解答 解:根据A和溴水的加成产物可判断A为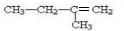 ,反应②是卤代烃的水解反应,生成物B为
,反应②是卤代烃的水解反应,生成物B为 ;B发生氧化反应得到C(
;B发生氧化反应得到C( ),由C、D的分子式可知,C发生消去反应生成D,且D分子中含有2个甲基,故D为
),由C、D的分子式可知,C发生消去反应生成D,且D分子中含有2个甲基,故D为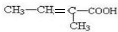 ,D在浓硫酸存在条件下发生酯化反应生成六元环酯G,则G为
,D在浓硫酸存在条件下发生酯化反应生成六元环酯G,则G为 ;反应⑤属于卤代烃的水解反应,则E的结构简式为
;反应⑤属于卤代烃的水解反应,则E的结构简式为 ,E和D发生酯化反应生成F为
,E和D发生酯化反应生成F为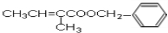 ,
,
(1)A的结构简式为: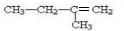 ,碳碳双键在1号C,甲基在2号C,其名称为:2-甲基-1-丁烯,
,碳碳双键在1号C,甲基在2号C,其名称为:2-甲基-1-丁烯,
故答案为:2-甲基-1-丁烯;
(2)合成路线中反应③为B 发生氧化反应得到C(
发生氧化反应得到C( ),该反应为氧化反应,
),该反应为氧化反应,
故答案为:氧化反应;
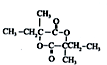
(3)D(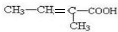 )在浓硫酸存在条件下发生酯化反应生成六元环酯G,则G的结构简式为:
)在浓硫酸存在条件下发生酯化反应生成六元环酯G,则G的结构简式为: ,
,
故答案为: ;
;
(4)D的结构简式为: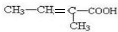 ,其分子中含有的官能团为碳碳双键和羧基,
,其分子中含有的官能团为碳碳双键和羧基,
故答案为:碳碳双键、羧基;
(5)C的结构简式为 ,
,
A.羧基、羟基能与钠反应生成氢气,而只有羧基与碳酸氢钠反应生成二氧化碳,等物质的量的C分别与足量的金属钠和NaHCO3反应,产生气体的物质的量相等,故A错误;
B.含有羧基、羟基,一定条件下,有机物C能通过缩聚反应形成高分子化合物,故B正确;
C.C的分子式为C5H10O3,改写为C4H8.CO2.H2O,1molC完全燃烧生成CO2和H2O,消耗的氧气的物质的量为(4+$\frac{8}{4}$)mol=6mo,故C正确;
D.存在甲烷的四面体结构,有机物C中的所有碳原子不可能在同一平面上,故D错误,
故答案为:BC;
(6)反应⑥为 和
和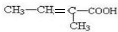 发生酯化反应生成
发生酯化反应生成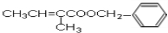 ,该反应的化学方程式为:
,该反应的化学方程式为: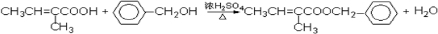 ,
,
故答案为: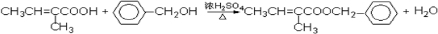 ;
;
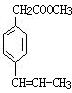
(7)在F的同分异构体中苯环上有两个取代基,且苯环上的一氯代物只有两种,说明这2个取代基一定是对位的.其中一个取代基为-CH2COOCH3,则另一个取代基含有碳碳双键,因此满足条件的同分异构体的结构简式为: 、
、 、
、 ,
,
故答案为: 、
、 、
、 .
.
点评 本题考查有机物的合成,题目难度中等,注意从A的结构入手采取正推的方法进行推断,把握官能团的性质以及官能团的转化为解答该题的关键,易错点为同分异构体的判断,注意把握题给信息.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题
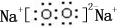 ;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)
;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在屋顶安装太阳能热水器为居民提供生活用水 | |
| B. | 用石灰对煤燃烧后形成的烟气脱硫,并回收石膏 | |
| C. | 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气作为家庭燃气 | |
| D. | 大力发展火力发电,解决广东电力紧张问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
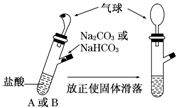 有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2 CO3 和0.84g NaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中下列叙述正确的是( )
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2 CO3 和0.84g NaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中下列叙述正确的是( )| A. | A装置的气球膨胀速率大 | |
| B. | 若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L | |
| C. | 若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L | |
| D. | 最终两试管中Na +、Cl - 的物质的量一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com