
分析 (1)同温同压下,气体分子数目之比等于体积之比;
(2)同温同压下,气体体积之比等于物质的量之比,结合分子含有原子数目计算;
(3)同温同压下,气体体积之比等于物质的量之比,再根据m=nM计算;
(4)同温同压下,气体体积之比等于物质的量之比;
(5)二氧化碳分子中含有22个电子,CO分子中含有14个电子,结合二者的物质的量之比计算出含有电子数之比;
(6)根据二者的物质的量之比计算出其平均摩尔质量;
(7)密度与摩尔质量成正比,根据(6)计算出的平均摩尔质量计算出该混合气体的密度对氢气的相对密度.
解答 解:(1)同温同压下,气体分子数目之比等于体积之比,故1体积的CO2和2体积的CO含有分子数目之比=1:2,
故答案为:1:2;
(2)同温同压下,气体体积之比等于物质的量之比,故1体积的CO2和2体积的CO的物质的量之比=1:2,则二者含有原子数目之比=1×3:2×2=3:4,
故答案为:3:4;
(3)同温同压下,气体体积之比等于物质的量之比,故1体积的CO2和2体积的CO的物质的量之比=1:2,则二者质量之比=1mol×44g/mol:2mol×28g/mol=11:14,故答案为:11:14;
(4)同温同压下,气体体积之比等于物质的量之比,则二者物质的量之比为1:2,
故答案为:1:2;
(5)根据(4)可知二者物质的量之比为1:2,二者含有的电子数之比=电子的物质的量之比=(1×22):(2×14)=11:14,
故答案为:11:14;
(6)根据(4)可知二者物质的量之比为1:2,则二者的平均摩尔质量=$\frac{44g/mol×1+28g/mol×2}{3}$=$\frac{100}{3}$g/mol=33.3g/mol,
故答案为:33.3g/mol;
(7)密度与摩尔质量成正比,混合气体的密度对氢气的相对密度=$\frac{100}{3}$g/mol:2g/mol=$\frac{50}{3}$,
故答案为:$\frac{50}{3}$.
点评 本题考查物质的量有关计算、阿伏伽德罗定律及推论,题目难度不大,根据pV=nRT理解阿伏伽德罗定律及推论,试题有利于提高学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
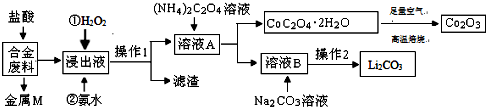
科目:高中化学 来源: 题型:解答题
 ;
; ;
; 和
和 .
.查看答案和解析>>
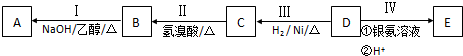
科目:高中化学 来源: 题型:解答题
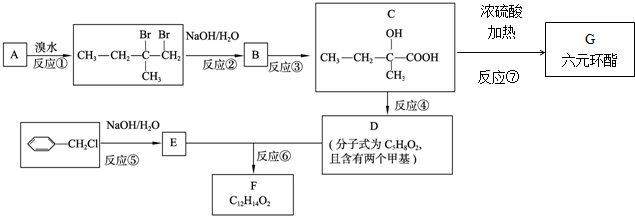
 .
.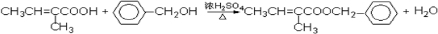 .
.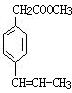 、
、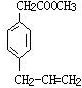 、
、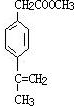 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2X2Q(g)+O2(g)═2Q(s)+2X2O(g)△H=-2a kJ•mol-1 | |
| B. | X2Q(g)+2O2(g)═QO3(g)+X2O(l)△H=+a kJ•mol-1 | |
| C. | 2X2Q(g)+3O2(g)═2QO2(g)+2X2O(l)△H=-2a kJ•mol-1 | |
| D. | X2Q(g)+2O2(g)=QO3(g)+X2O(l)△H=-a kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
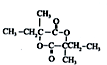
科目:高中化学 来源: 题型:解答题
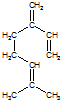 ,也可简写为
,也可简写为 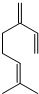 ,其分子式是C10H16,可以发生的化学反应有①④(选填序号).
,其分子式是C10H16,可以发生的化学反应有①④(选填序号).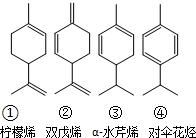
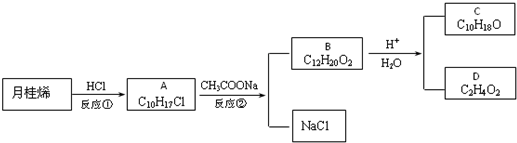
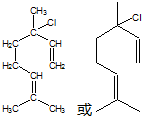 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO) | |
| B. | 水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应 | |
| C. | 醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则b<a+1 | |
| D. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(Na+)最小的是Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com