
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
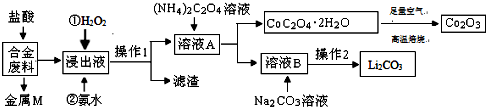
分析 合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)加入盐酸过滤得到金属M为不与盐酸反应的铜,浸出液中加入过氧化氢氧化亚铁离子为铁离子,加入氨水调节溶液PH使铁离子转化为氢氧化铁沉淀,通过操作Ⅰ过滤得到溶液A中加入草酸铵溶液沉淀钴离子过滤得到溶液B主要是锂离子的溶液,加入碳酸钠沉淀锂离子,过滤得到碳酸锂;结晶析出CoC2O4•2H2O足量空气煅烧得到氧化钴,以此解答该题.
解答 解:合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)加入盐酸过滤得到金属M为不与盐酸反应的铜,浸出液中加入过氧化氢氧化亚铁离子为铁离子,加入氨水调节溶液PH使铁离子转化为氢氧化铁沉淀,通过操作Ⅰ过滤得到溶液A中加入草酸铵溶液沉淀钴离子过滤得到溶液B主要是锂离子的溶液,加入碳酸钠沉淀锂离子,过滤得到碳酸锂;结晶析出CoC2O4•2H2O足量空气煅烧得到氧化钴,
(1)上述分析判断金属M为Cu,故答案为:Cu;
(2)加入H2O2的作用是氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;加入氨水的作用是调节溶液PH使Fe3+转化为Fe(OH)3沉淀,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;调节溶液的pH使Fe3+转化为Fe(OH)3沉淀;
(3)CoC2O4焙烧生成Co2O3、CO2和水,反应的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8H2O+8CO2,
故答案为:4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8H2O+8CO2;
(4)Li2CO3微溶于水,溶解度随温度升高而降低,为减少Li2CO3的溶解损失,蒸发浓缩后必须趁热过滤,90℃时c(Li2CO3)的浓度为0.10mol/L,则c(Li+)=0.20mol/L,c(CO32-)=0.10mol/L,则Ksp(Li2CO3)=0.20×0.20×0.10=4.0×10-3,
故答案为:减少Li2CO3的溶解损失;4.0×10-3.
点评 本题主要考查物质的分离提纯的综合应用,为高频考点,侧重于学生的分析能力和实验能力、计算能力的考查,综合性强,注意把握实验的流程和原理,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 10g46%的乙醇溶液所含氢原子数为1.2 NA | |
| B. | 0.5 mol Na2O2中含有的离子数目为2NA | |
| C. | 标准状况下,2.24 L甲醇中含有C-H键的数目为0.3NA | |
| D. | S2和S8的混合物共38.4 g,其中所含硫原子数为1.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
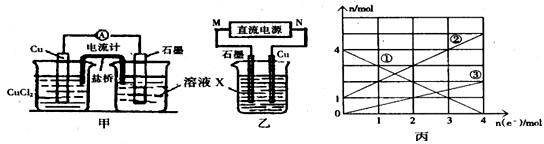
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.012 kg 12C中含有约 6.02×1023 个碳原子 | |
| B. | 1 mol H2O中含有2 mol氢和1 mol氧 | |
| C. | 氢氧化钠的摩尔质量等于它的相对分子质量 | |
| D. | 2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化还原反应在生产、生活中具有广泛的用途、贯穿古今.
氧化还原反应在生产、生活中具有广泛的用途、贯穿古今.
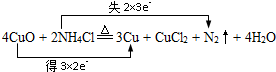 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com