
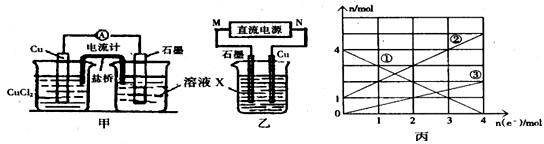
���� ��1�����ɼ��з�ӦΪ2FeCl3+Cu�T2FeCl2+CuCl2���з�����
��ͭ������ʧ���ӷ���������Ӧ��
���������������������ƶ���
��2���ٸ��ݱ�ͼ��֪��Һ�������ֽ��������ӣ�������X�ijɷֿ�֪X��ֻ�����ֽ��������ӣ�˵���ڵ������л���Cu2+���ɣ����Cu��������ʯī��������
�ڸ���ת�Ƶ��ӵ����ʵ����ͽ��������ӵ����ʵ����ı仯ȷ�����߶�Ӧ�����ӣ�
�۽��ת�Ƶ��ӵ����ʵ������㣻
��3�����õ�ⷨ�Ʊ������ƣ����ʱ��ʧȥ���ӷ���������Ӧ�������������������������Ӻ�ˮ��
��NaClO����Fe��OH��3���ɸ������ơ��Ȼ��ƺ�ˮ�����ݵ�ʧ�����غ�д�����ӷ���ʽ��
�۸������ƾ���ǿ��������ɱ���������ڷ�Ӧ�����б���ԭΪ��������ˮ��Һ��ˮ�����������������壮
��� �⣺��1���پݷ�Ӧ������������ȷ�����з�ӦΪ2FeCl3+Cu�T2FeCl2+CuCl2����XΪFeCl3���ʴ�Ϊ��FeCl3��
��ͭ������ʧ���ӷ���������Ӧ���缫��ӦΪCu-2e-=Cu2+���ʴ�Ϊ��Cu-2e-=Cu2+��
��Cu��������ʯī���������������������������ƶ�����K+������������������X��Һ�У��ʴ�Ϊ��K+��
��2���ٸ��ݱ�ͼ��֪��Һ�������ֽ��������ӣ�������X�ijɷֿ�֪X��ֻ�����ֽ��������ӣ�˵���ڵ������л���Cu2+���ɣ����Cu��������ʯī����������MΪ������NΪ�������ʴ�Ϊ������
���ڵ���������Cu2+���ɣ���Cu2+�����ʵ����������������Ԣ�ΪCu2+����ͼ��֪���ٱ�ʾ�Ľ������ӵ����ʵ����������٣���ΪFe3+�����Ԣ�ΪFe2+���ʴ�Ϊ��Fe2+��
�۵�����ת��Ϊ2molʱ����Һ����Fe3+ 2mol��Fe2+ 3mol��Cu2+Ϊ1mol��������Ҫ����NaOH��Һ14mol������NaOH��Һ�����Ϊ$\frac{14mol}{5mol/L}$=2.8L��
�ʴ�Ϊ��2.8��
��3��������������������������Ʊ������ƣ����ʱ��ʧȥ���ӷ���������Ӧ�������������������������Ӻ�ˮ���缫��ӦʽΪ��Fe+8OH--6e-=FeO42-+4H2O���ʴ�Ϊ��Fe+8OH--6e-=FeO42-+4H2O��
��NaClO����Fe��OH��3�ķ�Ӧ����ʽΪ2Fe��OH��3+3ClO-+4OH-�T2FeO42-+3Cl-+5H2O���ʴ�Ϊ��2Fe��OH��3+3ClO-+4OH-�T2FeO42-+3Cl-+5H2O��
��Na2FeO4����������ˮ��ԭ���Ǹ������������ԣ�������ɱ��������Fe3+�γɽ��壬��������������ľ�ˮ�����ã�
�ʴ�Ϊ���������������ԣ���ɱ�����������ɵ�Fe3+ˮ���γɽ��壬��������������ľ�ˮ���ã�
���� ���⿼��ԭ��ء����ع���ԭ����֪ʶ���ۺ���ǿ���Ѷȴ���Ҫ����ѧ������������������Ǹ߿����ȵ�ϰ�⣮


 ��ְٷְټ���ϵ�д�
��ְٷְټ���ϵ�д� �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д� �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ������ƿ��ת����Һ | B�� |  ������������ | ||
| C�� |  ̼���������ȷֽ� | D�� |  ��ȡ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʯ�͵ķ���ú�ĸ����������仯 | |
| B�� | ��ѧ��Ӧ�����Dz��ɸı�� | |
| C�� | �����Ҵ���ȡ��ˮ�е��� | |
| D�� | �ڹ���Ԫ����Ѱ�Ҵ��������¡���ʴ�ĺϽ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
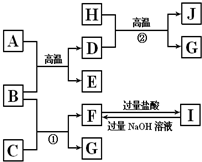 ͼ��A��J�������������ˮ��Һ������B��D��G�ǵ��ʣ�B�ǵؿ��к�����ߵĽ���Ԫ�أ�G�����壬J�Ǵ��Բ��ϣ�
ͼ��A��J�������������ˮ��Һ������B��D��G�ǵ��ʣ�B�ǵؿ��к�����ߵĽ���Ԫ�أ�G�����壬J�Ǵ��Բ��ϣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
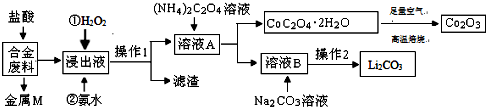
 ��ҵ�ϡ��̶���������CO2����Ч�ؼ��ᡰ���ҡ�ЧӦ������CO2����ȼ�ϼ״���
��ҵ�ϡ��̶���������CO2����Ч�ؼ��ᡰ���ҡ�ЧӦ������CO2����ȼ�ϼ״����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/�� | 10 | 30 | 60 | 90 |
| Ũ��/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼΪʵ����ijŨ�����Լ�ƿ��ǩ�ϵ��й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺
��ͼΪʵ����ijŨ�����Լ�ƿ��ǩ�ϵ��й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
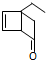 �������й���������ȷ���ǣ�������
�������й���������ȷ���ǣ�������| A�� | ���ܷ����Ӿ۷�Ӧ | |
| B�� | ����ʽΪC8H10O | |
| C�� | ������������Ӧ����������к����ǻ� | |
| D�� | �ܷ���������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2X2Q��g��+O2��g���T2Q��s��+2X2O��g����H=-2a��kJ•mol-1 | |
| B�� | X2Q��g��+2O2��g���TQO3��g��+X2O��l����H=+a��kJ•mol-1 | |
| C�� | 2X2Q��g��+3O2��g���T2QO2��g��+2X2O��l����H=-2a��kJ•mol-1 | |
| D�� | X2Q��g��+2O2��g��=QO3��g��+X2O��l����H=-a��kJ•mol-1 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com