
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 结构或性质信息 |
| T | 基态原子的L层上s电子数等于p电子数 |
| X | 基态原子最外层未成对电子数在该元素所在周期中最多 |
| Y | 基态原子的第一电离能在该元素所在周期中最小 |
| Z | 单质常温、常压下是气体。基态原子的M层上有1个未成对的p电子 |
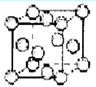

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | I1 | I2 | I3 | I4 |
| C | 738 | 1451 | 7733 | 10540 |
| D | 577 | 1817 | 2745 | 11578 |
| | 单键 | 双键 | 叁键 | |
| AB | 键能(kJ·mol―1) | 357.7 | 798.9 | 1071.9 |
| 甲 | 键能(kJ·mol―1) | 154.8 | 418.4 | 941.7 |
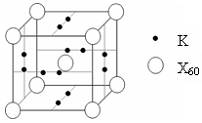
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.微粒半径大小:S2- >Cl- >F- >Na+ >Al3+ |
| B.热稳定性大小:SiH4>PH3>NH3>H2O |
| C.沸点高低:HF>H2O>NH3 |
| D.等物质的量浓度溶液,酸性强弱顺序: H2SO4>H3PO4>H2SiO3>HNO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com