
【题目】化合物H是一种医药中间体,其合成路线如图:
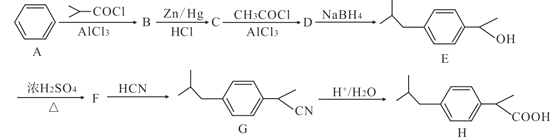
已知:
①![]()
![]()
![]()
②![]()
![]()
![]()
(1)B中所含官能团的名称是______,H的最简单同系物名称为______。
(2)B→C的反应类型是______。
(3)F的结构简式为______。
(4)C→D的化学方程式为______。
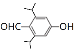
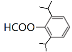
(5)芳香族化合物X是H的同分异构体,X能发生银镜反应,其核磁共振氢谱显示有5组峰,且峰面积比为12:2:2:1:1,符合要求的X的结构简式为______。
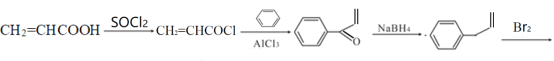
(6)已知RCOOH+SOCl→RCOCl,写出以苯和丙烯酸(CH2=CHCOOH)为原料制备![]() 的合成路线(无机试剂任选):______。
的合成路线(无机试剂任选):______。
【答案】羰基 苯甲酸 还原反应 ![]()
![]()
![]() 、
、 、
、![]() 、
、
![]()
【解析】
苯发生已知①的取代反应生成B(![]() ),B发生已知②的还原反应生成C(
),B发生已知②的还原反应生成C(![]() ),C再发生已知①的取代反应生成D(
),C再发生已知①的取代反应生成D(![]() ),D发生还原反应生成E,E在浓硫酸加热条件下发生消去反应生成F(
),D发生还原反应生成E,E在浓硫酸加热条件下发生消去反应生成F(![]() ),F与HCN发生取代反应生成G,氰基在稀酸条件下生成羧基。
),F与HCN发生取代反应生成G,氰基在稀酸条件下生成羧基。
(1)由B的结构可知含有的官能团为羰基,H为芳香酸类,其最简单同系物名称为苯甲酸,故答案为:羰基;苯甲酸;
(2)由分析知,B→C的反应类型是还原反应,故答案为:还原反应;
(3)F的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)C→D发生的是已知①的反应,其化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)X能发生银镜反应,为醛基或甲酸酯类,其核磁共振氢谱显示有5组峰,且峰面积比为12:2:2:1:1,则符合要求的X的结构简式为![]() 、
、 、
、![]() 、
、 ,故答案为:
,故答案为:![]() 、
、 、
、![]() 、
、 ;
;
(5)丙烯酸(CH2=CHCOOH)先发生已知RCOOH+SOCl→RCOCl反应生成CH2=CHCOCl,后与苯发生已知①的反应生成![]() ,
,![]() 在被NaBH4还原为
在被NaBH4还原为![]() ,最后与溴加成即可得到目标产物,故答案为:
,最后与溴加成即可得到目标产物,故答案为:
![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】汽车尾气(含CO、SO2、NO等)是城市空气的污染源之一,治理方法之一是在汽车的排气管上装一个“催化转化器”(用铂、钯合金作催化剂),它能使一氧化碳跟一氧化氮反应生成可参与大气循环的无毒气体。
(1)汽车尾气中导致酸雨形成的主要物质是________(填化学式)。
(2)在汽车排气管上加装“催化转化器”,可使CO和NO反应产生可参与大气循环的无毒气体,请写出该反应的化学方程式:__________。该反应的还原剂为:______氮元素的化合价_______(填“升高”或“降低”)。
(3)请写出汽车尾气形成硝酸型酸雨的主要反应的化学方程式:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某密闭容器中发生反应:2HI(g)H2(g)+I2(g),若 15 s 内 c(HI)由 0.1 mol·L-1 降到 0.07 mol·L-1,则下列说法正确的是
A.0~15 s 内用 I2 表示的平均反应速率为 v(I2)=0.015 mol·L-1·s-1
B.c(HI)由 0.07 mol ·L-1 降到 0.05 mol·L-1 所需的反应时间小于 10 s
C.升高温度,正反应速率加快,逆反应速率减慢
D.减小容器的体积,反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。

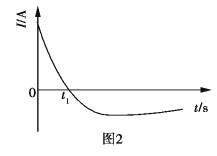
下列说法错误的是( )
A.0~t1时,原电池的负极是Al片
B.0~t1时,正极的电极反应式是![]() +2H++e=NO2↑+H2O
+2H++e=NO2↑+H2O
C.t1后,原电池的正、负极发生互变
D.t1后,正极上每得到0.3mol电子,则负极质量减少2.7g
查看答案和解析>>
科目:高中化学 来源: 题型:
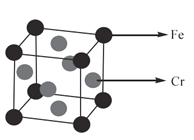
【题目】不锈钢(Stainless Steel)是不锈耐酸钢的简称,耐空气、蒸汽、水等腐蚀。不锈钢中含有Fe、Cr等元素。回答下列问题:
(1)铬(Cr)的价电子排布图为______
(2)亚铁氰化钾别名黄血盐,化学式:![]() ,加入食盐中可防止食盐板结。其中C、N、O三元素的第一电离能由小到大顺序为______。O和N的简单氢化物沸点明显高于CH4原因是______,其不含结晶水的盐结构如图所示,其中C原子的杂化方式为______。
,加入食盐中可防止食盐板结。其中C、N、O三元素的第一电离能由小到大顺序为______。O和N的简单氢化物沸点明显高于CH4原因是______,其不含结晶水的盐结构如图所示,其中C原子的杂化方式为______。

(3)1mol的![]() 中含有的共价键物质的量为______mol,该配位化合物的配位原子为______。
中含有的共价键物质的量为______mol,该配位化合物的配位原子为______。
(4)用______实验可以直接确定某固体是否是晶体,某种铁铬合金的晶胞如图所示,该晶体堆积模型为______,空间利用率是______;若已知该晶胞的棱长为a pm,则该晶胞的密度为______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A.用明矾作净水剂:Al3+ + 3H2O![]() Al(OH)3(胶体)+ 3H+
Al(OH)3(胶体)+ 3H+
B.NO2球浸泡在冷水中,颜色变浅: 2NO2(g) ![]() N2O4(g) ΔH< 0
N2O4(g) ΔH< 0
C.用醋酸除去水垢:2H++CaCO3 = Ca2++CO2↑+H2O
D.CO2通入苯酚钠溶液中出现浑浊:![]() +CO2+H2O→
+CO2+H2O→![]() +NaHCO3
+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维纶(聚乙烯醇缩甲醛纤维)可用于生产服装、绳索等。其合成路线如下:
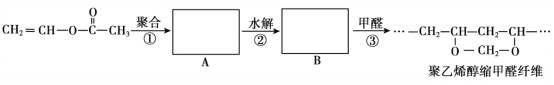
下列说法不正确的是
A.反应①是加聚反应
B.高分子A的链节中只含有一种官能团
C.通过质谱法测定高分子B的平均相对分子质量,可得其聚合度
D.反应③的化学方程式为:![]() +nHCHO→
+nHCHO→![]() +(2n-1)H2O
+(2n-1)H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法 命名下列有机物
(1)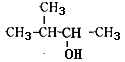 ____________________________________________, 由 该 物 质 制 得 烯 烃 的 反 应 条 件 为_____,
____________________________________________, 由 该 物 质 制 得 烯 烃 的 反 应 条 件 为_____,
(2)![]() _____,由该物质生成顺式聚合物的结构简式是_____。
_____,由该物质生成顺式聚合物的结构简式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组进行测定某变质的铁铝合金(杂质主要为Al2O3和Fe2O3)样品中铁含量,并制备Fe3O4胶体粒子,相关实验方案设计如下:

已知:乙醚[(C2H5)2O]易燃,沸点为34.5度,微溶于水,密度比水小。在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚;当盐酸浓度降低时,该化合物解离。
请回答下列问题:
(1)溶液II中主要金属阳离子是__________________。
(2)步骤I中试剂A最佳选择的是_____________。
A.浓硝酸 B.浓硫酸 C.浓盐酸+双氧水 D.稀盐酸+双氧水
(3)步骤II的“一系列操作”包括如下实验步骤,选出其正确操作并按序列出字母:分液漏斗中加水检验是否漏水→向溶液中加入适量浓盐酸和乙醚,转移至分液漏抖→(__________)→(_________)→(__________)→(__________)→f→(_________)→a→(__________)→d→(_________)。
a.左手拇指和食指旋开旋塞放气;
b.用右手压住玻璃塞,左手握住旋塞,将分液漏斗倒转,并用力振摇;
c.静置分层;
d.打开上口玻璃塞,将下层液体从下口放出,上层液体从上口倒出;
e.混合两次分液后的上层液体;
f.向下层液体中加入浓盐酸和乙醚并转移至分液漏斗;
(4)下列关于步骤Ⅲ和步骤VI的涉及的操作说法正确的是_______________。
A.步骤Ⅲ中蒸馏操作时,为加快蒸馏速度,采用酒精灯大火加热,收集34.5℃的馏分
B.为减少乙醚挥发,在蒸馏操作时,收集乙醚的锥形瓶应放置在冰水浴中
C.步骤VI由混合溶液制得Fe3O4胶体粒子的过程中,须持续通入N2,防止Fe2+被氧化
D.析出Fe3O4胶体粒子后通过抽滤,洗涤,干燥获得Fe3O4胶体粒子
(5)步骤IV测定Fe3+方法有多种,如转化为Fe2O3,间接碘量滴定,分光光度法等。
①步骤IV主要作用是测定样品中的铁总含量和______________________。
②步骤IV实验时采用间接碘量法测定Fe3+含量,具体过程如下:向25.00mL溶液中加入过量KI溶液,充分反应后,滴入几滴淀粉作指示剂,用0.1000mol·L-1Na2S2O3标准溶液进行滴定,到达滴定终点时,消耗Na2S2O3标准溶液体积为VmL。已知滴定反应为:I2+2Na2S2O3=2NaI+Na2S4O6。不考虑Fe3+和I-反应限度和滴定操作问题,实际测定的Fe含量往往偏高,其主要原因是________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com