
【题目】不锈钢(Stainless Steel)是不锈耐酸钢的简称,耐空气、蒸汽、水等腐蚀。不锈钢中含有Fe、Cr等元素。回答下列问题:
(1)铬(Cr)的价电子排布图为______
(2)亚铁氰化钾别名黄血盐,化学式:![]() ,加入食盐中可防止食盐板结。其中C、N、O三元素的第一电离能由小到大顺序为______。O和N的简单氢化物沸点明显高于CH4原因是______,其不含结晶水的盐结构如图所示,其中C原子的杂化方式为______。
,加入食盐中可防止食盐板结。其中C、N、O三元素的第一电离能由小到大顺序为______。O和N的简单氢化物沸点明显高于CH4原因是______,其不含结晶水的盐结构如图所示,其中C原子的杂化方式为______。

(3)1mol的![]() 中含有的共价键物质的量为______mol,该配位化合物的配位原子为______。
中含有的共价键物质的量为______mol,该配位化合物的配位原子为______。
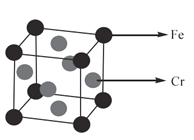
(4)用______实验可以直接确定某固体是否是晶体,某种铁铬合金的晶胞如图所示,该晶体堆积模型为______,空间利用率是______;若已知该晶胞的棱长为a pm,则该晶胞的密度为______g/cm3。
【答案】![]() C< O< N 水和氨气存在分子间氢键,沸点升高 sp杂化 24 碳原子 X-射线衍射 面心立方最密堆积 74%
C< O< N 水和氨气存在分子间氢键,沸点升高 sp杂化 24 碳原子 X-射线衍射 面心立方最密堆积 74% ![]()
【解析】
(1)铬(Cr)为24号元素,价电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)根据元素周期律,同周期从左到右,元素的第一电离能逐渐增大,但因为N元素2p轨道半充满状态,所以N的第一电离能高于O,则C、N、O三元素的第一电离能由小到大顺序为C <O<N;O和N的简单氢化物分别为水、氨气,因为水和氨气都存在分子间氢键,所以沸点明显高于CH4;由图可知,碳原子形成2根σ键,则C原子的杂化方式为sp杂化,故答案为:C <O<N;水和氨气都存在分子间氢键,沸点升高;
(3)![]() 中铁原子与CN-间能形成配位共价键,碳原子与氮原子间能形成叁键,则1mol的
中铁原子与CN-间能形成配位共价键,碳原子与氮原子间能形成叁键,则1mol的![]() 中含有的共价键物质的量为(6+3×6)mol=24mol,由图可知该配位化合物的配位原子为碳原子,故答案为:24;碳原子;
中含有的共价键物质的量为(6+3×6)mol=24mol,由图可知该配位化合物的配位原子为碳原子,故答案为:24;碳原子;
(4)用X-射线衍射实验可以直接确定某固体是否是晶体,由图原子在顶点和面心可知,该晶体堆积模型为面心立方最密堆积,空间利用率是74%;若已知该晶胞的棱长为a pm,由密度计算公式![]() ,即该晶胞的密度为
,即该晶胞的密度为![]() g/cm3,故答案为:X-射线衍射;面心立方最密堆积;74%;
g/cm3,故答案为:X-射线衍射;面心立方最密堆积;74%;![]() 。
。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】
铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
)分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
(3)C、H、O 三种元素的电负性由小到大的顺序为________________。
(4)乙醇的沸点高于丙酮,这是因为____________________。
(5)某FexNy的晶胞如题21图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如题21图-2 所示,其中更稳定的Cu替代型产物的化学式为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.电解精炼铜时,阳极泥中含有![]() 等金属
等金属
B.![]() 通入足量水中,转移电子的数目为
通入足量水中,转移电子的数目为![]()
C.反应![]() 在常温下不能自发进行,说明该反应的
在常温下不能自发进行,说明该反应的![]()
D.等质量的硫蒸气和硫粉分别在空气中完全燃烧,前者放出热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛酸(OHC-COOH )是一种重要的精细化工产品。以高硅铸铁为惰性电极材料,用恒电势电解NaBr 溶液间接氧化乙二醛(OHC-CHO)制备乙醛酸:OHC-CHO+Br2+H2O→OHC-COOH+2HBr。装置如图所示,下列说法不正确的是( )
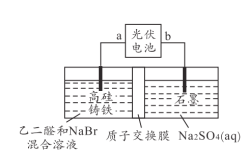
A.电极b为负极,高硅铸铁不损耗
B.阳极的电极反应式为2Br--2e-=Br2
C.光伏电池将铸铁极的电子转移到石墨极
D.电解过程中,右室溶液的pH逐渐升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 正四面体烷![]() 与立方烷
与立方烷![]() 的二氯代物数目相同
的二氯代物数目相同
B. 淀粉的水解产物为葡萄糖,葡萄糖在酒化酶作用下再进一步水解可得酒精
C. 75%的乙醇溶液可用于医疗消毒,福尔马林可用于浸制动物标本,二者都使蛋白质变 性
D. 甘氨酸和丙氨酸混合物发生缩合只能形成 2 种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
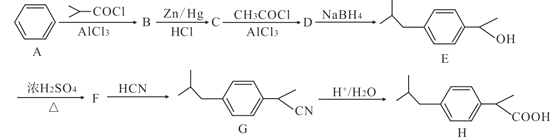
【题目】化合物H是一种医药中间体,其合成路线如图:
已知:
①![]()
![]()
![]()
②![]()
![]()
![]()
(1)B中所含官能团的名称是______,H的最简单同系物名称为______。
(2)B→C的反应类型是______。
(3)F的结构简式为______。
(4)C→D的化学方程式为______。
(5)芳香族化合物X是H的同分异构体,X能发生银镜反应,其核磁共振氢谱显示有5组峰,且峰面积比为12:2:2:1:1,符合要求的X的结构简式为______。
(6)已知RCOOH+SOCl→RCOCl,写出以苯和丙烯酸(CH2=CHCOOH)为原料制备![]() 的合成路线(无机试剂任选):______。
的合成路线(无机试剂任选):______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】疫情期间某同学尝试在家自制含氯消毒剂。用两根铅笔芯(C1和C2)、电源适配器和水瓶组装如图所示的装置。接通电源观察到:C1周围产生细小气泡,C2周围无明显现象;持续通电一段时间后,C2周围产生细小气泡。此时停止通电,拔出电极,旋紧瓶塞,振荡摇匀,制备成功。关于该实验的说法不正确的是

A.C1电极产生气泡原因:2H2O+2e-= H2↑+2OH-
B.自制消毒剂的总反应为:NaCl+H2O![]() NaClO+H2↑
NaClO+H2↑
C.可以用两根铁钉代替铅笔芯完成实验
D.实验过程中要注意控制电压、开窗通风、导出氢气,确保安全
查看答案和解析>>
科目:高中化学 来源: 题型:
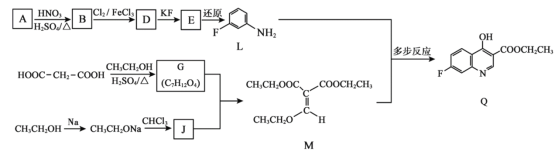
【题目】抗肿瘤药物7–氟喹啉衍生物的前体Q的合成路线如下:
已知:R1ONa+R2C1→R1OR2+NaCl(R1、R2代表烃基)
(1)A属于芳香烃,A的名称是_______。
(2)B→D的化学方程式是_______。
(3)D→E的反应类型是_______。
(4)G的结构简式是_______。
(5)下列关于M的说法正确的是_______(填序号)。
a.M含有两种不同的官能团 b.M存在顺反异构体
c.M和G能用Br2的CCl4溶液鉴别 d.M能与NaOH溶液反应
(6)已知:G + J → M + 2CH3CH2OH。J的结构简式是_________。
(7)L与M反应生成Q的过程如下:

已知:上述异构化反应中,只存在氢原子和不饱和键的位置变化。Y的分子中含有两个六元环。Y的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
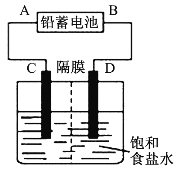
铅蓄电池充、放电时的电池反应为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
(1)铅蓄电池放电时的正极反应为___。
(2)请写出电解饱和食盐水的化学方程式:____。
(3)若在电解池C极一侧滴入几滴酚酞溶液,电解一段时间后溶液变红色,说明铅蓄电池的A极为___极。
(4)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1.15g·cm-3)时,
①若收集到11.2L(标准状况下)氯气,则至少转移电子____mol。
②若铅蓄电池消耗2molH2SO4,则可收集到H2的体积(标准状况下)为___L。
③若蓄电池消耗amol硫酸,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气和氢气全部排出)___(用含a的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com