
����Ŀ��ұ�������ȼ���״������һ����ҵ������ͼ��ʾ��������������Դ�������ʣ����ٻ�����Ⱦ����ش��������⣺

��1��Ti��ԭ������Ϊ22��Tiλ��Ԫ�����ڱ��е�_______���ڡ�
��2��д���������ڸ������뽹̿���Ȼ��õ����Ȼ��ѵĻ�ѧ����ʽ_______________��
��3���Ʊ�TiO2�ķ���֮һ������TiCl4ˮ������TiO2��x H2O���پ������Ƶá�ˮ��ʱ����������ˮ�����ȣ����ϻ�ѧ����ʽ�ͱ�Ҫ������˵��ԭ��_________________________________________��
��4����TiCl4��Ti ��Ҫ��Ar���н��е�������_________________________________����Ӧ��õ�Mg��MgCl2��Ti�Ļ����ɲ����������ķ�������õ�Ti�������±���Ϣ������ȵ��¶��Ը���___________�����ɡ�
TiCl4 | Mg | MgCl2 | Ti | |
�۵�/�� | ��25.0 | 648.8 | 714 | 1667 |
�е�/�� | 136.4 | 1090 | 1412 | 3287 |
��5����������ԭ�ζ����ⶨTiO2������������һ�������£���TiO2�ܽⲢ��ԭΪTi3+ ������KSCN��Һ��ָʾ������NH4Fe(SO4)2����Һ�ζ�Ti3+��ȫ������Ti4+���ζ�����ʱ����ȡTiO2��Ħ������ΪM g/mol������w g������c mol/L NH4Fe(SO4)2����ҺV mL����TiO2��������Ϊ___________________�����ô���ʽ��ʾ��
��6����CO��H2�ϳɼ״��ķ���ʽ�ǣ�CO(g)��2H2(g) ![]() CH3OH(g)�����������������������ʵ��κ���ʧ��������ҵ����ÿ�ϳ�6mol�״�����������ⲹ��H2 ____mol��
CH3OH(g)�����������������������ʵ��κ���ʧ��������ҵ����ÿ�ϳ�6mol�״�����������ⲹ��H2 ____mol��
���𰸡� �� 2FeTiO3+6C+7Cl2![]() 2FeCl3+ 2TiCl4+6CO TiCl4+(2+x)H2O
2FeCl3+ 2TiCl4+6CO TiCl4+(2+x)H2O![]() TiO2��xH2O+4HCl���������ˮ���������Ȼ���ӷ���ʹƽ�������ƶ����ٽ�ˮ��������ȫ�����ʹˮ����������� ��ֹ�ѡ�þ�����������ֹ��þ�������ˮ��Ӧ�� 1412
TiO2��xH2O+4HCl���������ˮ���������Ȼ���ӷ���ʹƽ�������ƶ����ٽ�ˮ��������ȫ�����ʹˮ����������� ��ֹ�ѡ�þ�����������ֹ��þ�������ˮ��Ӧ�� 1412 ![]() ����
����![]() %�� 5
%�� 5
��������������Ҫ���������Ʊ���̽��ʵ�顣
��1��Ti��ԭ������Ϊ22��Tiλ��Ԫ�����ڱ��е������ڡ�
��2���������ڸ������뽹̿���Ȼ��õ����Ȼ��ѣ�ͬʱ�õ�FeCl3��CO����ѧ����ʽ��2FeTiO3+6C+7Cl2![]() 2FeCl3+2TiCl4+6CO��
2FeCl3+2TiCl4+6CO��
��3��ˮ��ʱ����������ˮ�����ȣ�ԭ��TiCl4+(2+x)H2O![]() TiO2��xH2O+4HCl���������ˮ���������Ȼ���ӷ���ʹƽ�������ƶ����ٽ�ˮ��������ȫ�����ʹˮ�����������
TiO2��xH2O+4HCl���������ˮ���������Ȼ���ӷ���ʹƽ�������ƶ����ٽ�ˮ��������ȫ�����ʹˮ�����������
��4����TiCl4��Ti��Ҫ��Ar���н��е������Ƿ�ֹ�ѡ�þ�����������ֹ��þ�������ˮ��Ӧ������Ӧ��õ�Mg��MgCl2��Ti�Ļ����ɲ����������ķ�������õ�Ti�������±���Ϣ������ȵ��¶��Ը���1412�����ɣ���ʱ�����Mg��MgCl��������Ti��
��5��TiO2��NH4Fe(SO4)2��e-����TiO2��������Ϊ![]() ����
����![]() %����
%����
��6��14NaCl+14H2O![]() 14NaOH+7H2��+7Cl2����2FeTiO3+6C+7Cl2
14NaOH+7H2��+7Cl2����2FeTiO3+6C+7Cl2![]() 2FeCl3+2TiCl4+6CO��6CO(g)��12H2(g)
2FeCl3+2TiCl4+6CO��6CO(g)��12H2(g) ![]() 6CH3OH(g)���ɼ����������������������ʵ��κ���ʧ��������ҵ����ÿ�ϳ�6mol�״�����������ⲹ��H25mol��
6CH3OH(g)���ɼ����������������������ʵ��κ���ʧ��������ҵ����ÿ�ϳ�6mol�״�����������ⲹ��H25mol��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼʵ��װ��������֤ijЩ���ʵ����ʣ����Թ�A��װ�������Ĺ���NaHCO3.�Իش��������⣺
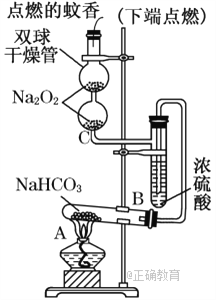
(1)��A�Թ��ڷ�����Ӧ�Ļ�ѧ����ʽ��____________________________________��
(2)Bװ�õ�������_______________________________________________________��
(3)��˫�������ڷ�����Ӧ�Ļ�ѧ����ʽΪ___________________________________��
(4)˫�������ڹ۲쵽��ʵ��������_________________________________________������ʵ������˵��________________________________________________________��
(5)����������ڵ�Na2O2����Na2O����˫�������ڹ۲쵽��ʵ��������______________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1.92 g CuͶ�뵽һ������Ũ������,ͭ��ȫ�ܽ�,���ɵ��������ɫԽ��Խdz,���ռ��� 672 mL ������(��״����)����ʢ�д����������������ˮ����,ͨ���״����һ�����������,ǡ��ʹ������ȫ����ˮ,��ͨ������������Ϊ����mL��
A.168B.224C.336D.504
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڵ�����Ԫ��A��B��C��D��E��ԭ��������������A��B��C����Ԫ�ص��Ӳ���֮����5��A��B��Ԫ��ԭ������������֮�͵���CԪ��ԭ��������������BԪ��ԭ��������Ӳ��ϵĵ����������ĵ��Ӳ�����2����A��D�����γ�ԭ�Ӹ����ȷֱ�Ϊ1��1��2��1������Һ̬�����E�������ھ���ˮ�ʡ���ش�
��1��E��ԭ�ӽṹʾ��ͼ��__________________��
���п�����֤C��D��Ԫ�طǽ�����ǿ����ʵ����ʵ��___________ ����д��ţ���
A���Ƚ�������Ԫ�ص���̬�⻯��ķе�
B���Ƚ�ֻ��������Ԫ�����γɵĻ������еĻ��ϼ�
C���Ƚ�������Ԫ�ص���̬�⻯����ȶ���
��2����A��B����Ԫ����ɵ���Ļ����д�������ʽ____��
��3������A��B��C��D����Ԫ����ɵ�ij��������ȿ��������ᷴӦ�ֿ�����NaOH��Һ��Ӧ���仯ѧʽΪ______________________��
��4����̬��������ҽѧ������Ҫ����;��������Fe3O4�Ǵ������е���Ҫ���ӣ����Ʊ����̿ɼ�ʾ���£�
�ٽ�������CA3ͨ������ʵ�����FeSO4��Fe2(SO4)3�Ļ����Һ�У��������ּд���÷�Ӧ���̵��ܵ����ӷ���ʽ____________________________________��
��������Ӧ���ɵ����ּ�������ã��õ�Fe3O4��д���÷�Ӧ�Ļ�ѧ����ʽ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������У�ͨ����������ɫ���ϡ��׳ơ����족���ǣ� ��
A. FeOB. Fe2O3C. Fe3O4D. Fe5O7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(AlN)��һ���������ǽ������ϡ�Ϊ�˷���ijAlN��Ʒ����Ʒ�е����ʲ���NaOH��Һ��Ӧ���� AlN�ĺ�����ijʵ��С���������������ʵ�鷽������֪��AlN+NaOH+H2O��NaAlO2+NH3��
������1��ȡһ��������Ʒ��������װ�òⶨ��Ʒ��AlN�Ĵ���(�г�װ������ȥ)��

��1����ͼCװ�������θ���ܵ������� ��
��2���������ʵ�鲽�裺��װ��ʵ��װ�ã��������װ�õ����������ټ���ʵ��ҩƷ����������ʵ������� ����Һ©������������NaOHŨ��Һ�������ٲ������塣��K1��ͨ�뵪��һ��ʱ�䣬�ⶨCװ�÷�Ӧǰ��������仯��ͨ�뵪����Ŀ���� ��
��3����������װ�û�����ȱ�ݣ����²ⶨ���ƫ�ߣ�������Ľ���� ��
������2�������²���ⶨ��Ʒ��A1N�Ĵ��ȣ�
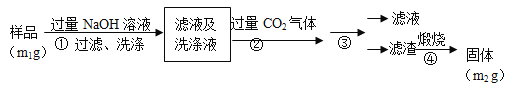
��4����������ɳ��������ӷ���ʽΪ_________________��
��5������۵IJ����� ��A1N�Ĵ����� ����m1��m2��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ�Ϻ췯�ƣ��ظ����ƣ�Na2Cr2O72H2O����Ҫ���Ը�������Ҫ�ɷ�ΪFeOCr2O3 �� ������Al2O3��SiO2�����ʣ�Ϊ��Ҫԭ������������Ҫ�����������£�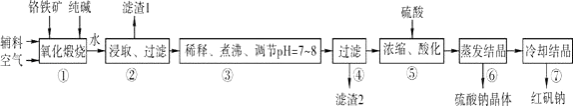
���������Ҫ��Ӧ�Ļ�ѧ����ʽ���£�
4FeOCr2O3+8Na2CO3+7O2�T8Na2CrO4+2Fe2O3+8CO2
��1�����з�Ӧ���ڻ�תҤ�н��еģ���Ӧʱ�費�Ͻ��裬�������� ��
��2������Al2O3�ڢ���ת���Ļ�ѧ��Ӧ����ʽΪ ��
��3���û�ѧƽ���ƶ�ԭ��˵��������е��������������ӷ���ʽ�������˵������������pH���Ͳ�����Ӱ���� ��
��4�������ữ��ʹCrO42��ת��ΪCr2O72��д���÷�Ӧ�����ӷ���ʽ�� �� 
��5����ҵ�ϻ����õ�ⷨ�Ʊ��ظ����ƣ���װ��ʾ��ͼ���ϣ������ĵ缫��ӦʽΪ��
�����ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com