
【题目】化工原料红矾钠(重铬酸钠:Na2Cr2O72H2O)主要是以铬铁矿(主要成分为FeOCr2O3 , 还含有Al2O3、SiO2等杂质)为主要原料生产,其主要工艺流程如下: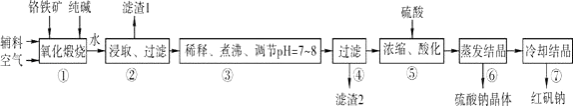
步骤①中主要反应的化学方程式如下:
4FeOCr2O3+8Na2CO3+7O2═8Na2CrO4+2Fe2O3+8CO2
(1)①中反应是在回转窑中进行的,反应时需不断搅拌,其作用是 .
(2)杂质Al2O3在①中转化的化学反应方程式为 .
(3)用化学平衡移动原理说明③中煮沸的作用是(用离子方程式结合文字说明),若调节pH过低产生的影响是 .
(4)⑤中酸化是使CrO42﹣转化为Cr2O72﹣写出该反应的离子方程式: . 
(5)工业上还可用电解法制备重铬酸钠,其装置示意图如上.阴极的电极反应式为;
阳极的电极反应式为 .
【答案】
(1)增大反应物的接触面积,加快反应速率
(2)Al2O3+Na2CO3 ![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
(3)水解吸热,煮沸促进水解平衡AlO2﹣+2H2O?Al(OH)3+OH﹣、SiO32﹣+2H2O?H2SiO3+2OH﹣向右移动,生成氢氧化铝、硅酸沉淀;H+将水解生成的氢氧化铝沉淀溶解,杂质Al3+与Na2CrO4难以分离
(4)2CrO42﹣+2H+?Cr2O72﹣+H2O
(5)4H2O+4e﹣=OH﹣+2H2↑;4OH﹣﹣4e﹣=2↑+2H2O
【解析】解:铬铁矿(主要成分为FeOCr2O3 , 还含有Al2O3、SiO2等杂质)加入碳酸钠煅烧,可生成Na2CrO4、Fe2O3、NaAlO2、Na2SiO3等,加入水浸取,得到滤渣1为Fe2O3 , 过滤后将滤液稀释、煮沸、调节pH7~8得到滤渣2为Al(OH)3、H2SiO3 , 过滤后将滤液酸化,发生了反应2Na2CrO4+H2SO4Na2SO4+Na2Cr2O7+H2O,生成了Na2Cr2O7和Na2SO4 , 蒸发结晶得到硫酸钠,冷却结晶得到Na2Cr2O72H2O,(1)①中反应是在回转窑中进行的,反应时需不断搅拌,可增大反应物的接触面积,加快反应速率,所以答案是:增大反应物的接触面积,加快反应速率;(2)杂质Al2O3在①中转化的化学反应方程式为Al2O3+Na2CO3 ![]() 2NaAlO2+CO2↑,所以答案是:Al2O3+Na2CO3
2NaAlO2+CO2↑,所以答案是:Al2O3+Na2CO3 ![]() 2NaAlO2+CO2↑;(3)滤液中含有NaAlO2、Na2SiO3等,都为强碱弱酸盐,加热煮沸,促进水解平衡AlO2﹣+2H2OAl(OH)3+OH﹣、SiO32﹣+2H2OH2SiO3+2OH﹣向右移动,生成氢氧化铝、硅酸沉淀,若调节pH过低,H+将水解生成的氢氧化铝沉淀溶解,杂质Al3+与Na2CrO4难以分离,所以答案是:水解吸热,煮沸促进水解平衡AlO2﹣+2H2OAl(OH)3+OH﹣、SiO32﹣+2H2OH2SiO3+2OH﹣向右移动,生成氢氧化铝、硅酸沉淀; H+将水解生成的氢氧化铝沉淀溶解,杂质Al3+与Na2CrO4难以分离;(4)酸化使CrO42﹣转化为Cr2O72﹣ , 反应的离子方程式为2CrO42﹣+2H+Cr2O72﹣+H2O,所以答案是:2CrO42﹣+2H+Cr2O72﹣+H2O;(5)溶液中有四种离子,重铬酸酸根,钠离子,氢离子和氢氧根,在阴极上氢离子放电:2 H++2e═H2↑或4H2O+4e﹣=OH﹣+2H2↑,在阳极上氢氧根放电:4OH﹣﹣4e﹣═O2↑+2H2O,所以答案是:4H2O+4e﹣=OH﹣+2H2↑;4OH﹣﹣4e﹣=2↑+2H2O.
2NaAlO2+CO2↑;(3)滤液中含有NaAlO2、Na2SiO3等,都为强碱弱酸盐,加热煮沸,促进水解平衡AlO2﹣+2H2OAl(OH)3+OH﹣、SiO32﹣+2H2OH2SiO3+2OH﹣向右移动,生成氢氧化铝、硅酸沉淀,若调节pH过低,H+将水解生成的氢氧化铝沉淀溶解,杂质Al3+与Na2CrO4难以分离,所以答案是:水解吸热,煮沸促进水解平衡AlO2﹣+2H2OAl(OH)3+OH﹣、SiO32﹣+2H2OH2SiO3+2OH﹣向右移动,生成氢氧化铝、硅酸沉淀; H+将水解生成的氢氧化铝沉淀溶解,杂质Al3+与Na2CrO4难以分离;(4)酸化使CrO42﹣转化为Cr2O72﹣ , 反应的离子方程式为2CrO42﹣+2H+Cr2O72﹣+H2O,所以答案是:2CrO42﹣+2H+Cr2O72﹣+H2O;(5)溶液中有四种离子,重铬酸酸根,钠离子,氢离子和氢氧根,在阴极上氢离子放电:2 H++2e═H2↑或4H2O+4e﹣=OH﹣+2H2↑,在阳极上氢氧根放电:4OH﹣﹣4e﹣═O2↑+2H2O,所以答案是:4H2O+4e﹣=OH﹣+2H2↑;4OH﹣﹣4e﹣=2↑+2H2O.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。请回答下列问题:

(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式_______________。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:_________________________________________。
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于___________℃即可。
TiCl4 | Mg | MgCl2 | Ti | |
熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) ![]() CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 ____mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 ____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 纯碱、烧碱均属碱 B. CO2属酸性氧化物
C. 凡能电离出H+的化合物均属酸 D. 凡能电离出OH—的化合物均属碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
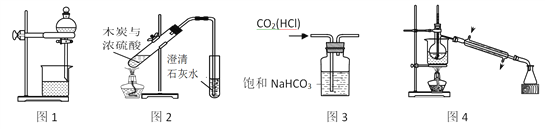
A. 图1用于分离酒精和水
B. 图2用于验证木炭与浓硫酸的反应产物中含有CO2
C. 图3用于除去CO2中的少量HCl
D. 图4用于制备蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A. 漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
B. 碳酸氢钙溶液中加入过量的氢氧化钠溶液:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
C. 向Fe2(SO4)3溶液中加入过量铁粉:2Fe3++Fe===3Fe2+
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+===H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素位于第三周期第ⅥA族.下列叙述不正确的是( )
A.该元素是非金属元素
B.该元素原子的核电荷数为16
C.该元素原子核外有3个电子层
D.该元素原子容易失去最外层电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5mol·L-1的盐酸10mL稀释到200mL,从中取出10mL的溶液的物质的量浓度是
A.0.05 mol·L-1B.0.25 mol·L-1
C.0.10 mol·L-1D.0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有碘水的试管里加入少量四氯化碳,振荡后静置,可观察到
A. 分层,上层呈紫红色,下层颜色变浅
B. 分层,上层颜色变浅,下层呈紫红色
C. 不分层,液体呈紫红色
D. 不分层,液体为无色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com