
【题目】硫酰氯(SO2Cl2)可用于有机合成和药物制造等。实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2[SO2(g)+Cl2(g)![]() SO2Cl2(l) ΔH= -97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法错误的是
SO2Cl2(l) ΔH= -97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法错误的是
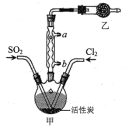
A.乙装置中盛放的试剂是P2O5,防止水蒸气进入装置中
B.装置甲应置于冰水浴中,目的是提高SO2Cl2产率
C.反应结束后,分离甲中混合物的实验操作是蒸馏
D.SO2、Cl2均可使品红试液褪色,原理不相同
【答案】A
【解析】
SO2Cl2沸点低、易挥发,根据装置图可知,三颈烧瓶上方的仪器的名称为球形冷凝管,作用是使挥发的产物SO2Cl2冷凝回流;由于会有一部分Cl2、SO2通过冷凝管逸出,Cl2、SO2都是有毒气体,故乙中应使用碱性试剂,又因SO2Cl2遇水能发生剧烈反应并产生白雾,所以乙中盛碱石灰吸收未反应的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止进入甲中导致硫酰氯水解;活性炭有多孔结构可以增大反应物之间的接触面,提高反应速率;分离沸点不同的液体可以用蒸馏的方法。
A. 乙装置中盛放的试剂是碱石灰,吸收未反应的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止进入甲中导致硫酰氯水解,故A错误;
B. 制备硫酰氯的反应为放热反应,装置甲应置于冰水浴中,可提高SO2Cl2产率,故B正确;
C. 根据硫酰氯的熔沸点数据,反应结束后,分离沸点不同的液体可以用蒸馏的方法,所以甲中混合物分离开的实验操作是蒸馏,故C正确;
D. SO2、Cl2均可使品红试液褪色,二氧化硫可以和有机色质结合而具有漂白性,氯水中的次氯酸具有氧化性而具有漂白性,二者漂白原理不一样,故D正确;
答案选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图是某元素的价类二维图。其中A是一种酸式盐,E的相对分子质量比D的相对分子质量大16,当x为一种强酸时,有如下转化关系。下列说法不正确的是( )
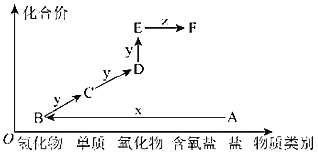
A.物质A、B、C、D、E、F中均含有硫元素
B.物质D可以使石蕊溶液先变红后褪色
C.物质C可在纯氧中燃烧,火焰呈蓝紫色
D.物质F的浓溶液可以用铁制容器盛放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求对图中两极进行必要的连接并填空:
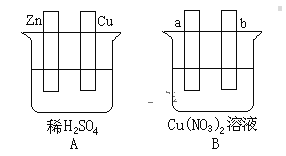
(1)在A图中,使铜片上冒H2气泡。请加以必要连接,则连接后的装置叫____。电极反应式:锌板:____;铜板:_____。
(2)在B图中,使a极析出铜,b极析出氧气。加以必要的连接后,该装置叫____。电极反应式,a极:____;b极:_____。经过一段时间后,停止反应,溶液的pH值____(升高、降低、不变),加入一定量的____后,溶液能恢复至与电解前完全一致。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
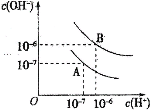
(1)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为______________。
(2)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________________。
(3)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积不变,则a=_________,实验②所得溶液中由水电离产生的c(OH-)=______。
(4)95℃时,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1 mol·/span>L-1 Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.l mol·L-1 NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显_____(填“酸”、“碱”或“中”)性。
②写出按乙方式混合后反应的化学方程式_______________________。所得溶液显______(填“酸”、“碱”或“中”)性。
③按甲方式混合,所得溶液的pH为________(混合时,忽略溶液体积的变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.可直接根据Ksp的数值大小比较难溶物在水中的溶解度
B.AgCl易转化为AgI沉淀且K(AgX)=c(Ag+)·c(X-),故K(AgI)<K(AgCl)
C.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
D.常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,若向50mL 0.018 mol·L-1的AgNO3溶液中加入50mL 0.020mol·L-1的盐酸(不考虑混合后溶液体积的变化)。
计算:
(1)混合溶液的pH。
(2)混合后溶液中的Ag+浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有Ag+的酸性溶液中,以铁铵矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.已知:AgSCN(白色s)![]() Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-
Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-![]() [Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
[Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
A. 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀
B. 当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点
C. 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+
D. 滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( )
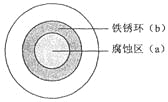
A.液滴中的Cl–由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1 KOH溶液滴定 10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。下列说法正确的是
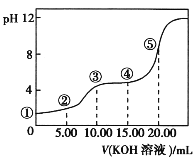
A.点①所示溶液中:![]() =1012
=1012
B.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
C.点③所示溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-)
D.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com