
【题目】已知Ksp(AgCl)=1.8×10-10,若向50mL 0.018 mol·L-1的AgNO3溶液中加入50mL 0.020mol·L-1的盐酸(不考虑混合后溶液体积的变化)。
计算:
(1)混合溶液的pH。
(2)混合后溶液中的Ag+浓度。
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种![]() 的系统,借助锂循环可持续合成氨,其原理如图所示:
的系统,借助锂循环可持续合成氨,其原理如图所示:
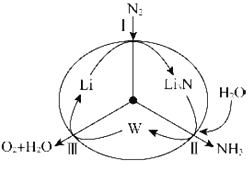
(1)过程Ⅰ得到Li3N的电子式为___________。
(2)过程Ⅱ生成W的化学反应方程式为____________。
(3)实验室制取氨气的化学反应方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如右图所示,下列说法中,正确的是
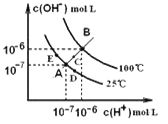
A. 图中A、B、D三点处KW间的关系: B>A>D
B. 100℃,向pH=2的稀硫酸中逐滴加入等体积pH=10的稀氨水,溶液中 c(NH4+)/c(NH3·H2O)减小,充分反应后,溶液到达B点
C. 温度不变,在水中加入适量NH4Cl固体,可从A点变化到C点
D. 加热浓缩A点所示溶液,可从A点变化到B点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是以煤炭为主要能源的发展中国家,煤炭燃烧产生的烟气中含有大量的NOx和SO2,带来了严重的大气污染。某化工小组进行了ClO2协同氨水法脱除模拟烟气中NOx和SO2的实验研究,其流程如图:
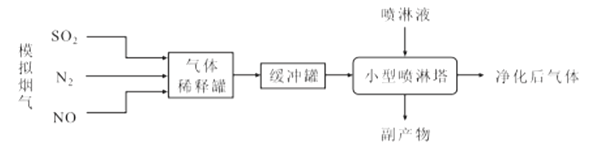
回答下列问题:
(1)制备“模拟烟气”时应首先向装置管道内通入__,目的是__。
(2)“喷淋液”中所含ClO2可通过向酸性氯酸钠溶液中加入葡萄糖的方法制备,同时产生CO2等物质,则该反应的离子方程式为__,还可将葡萄糖替换为__(填字母标号)。
A.FeCl3溶液 B.SO3 C.甲醇 D.酸性KMnO4溶液
(3)利用ClO2协同氨水进行脱硫脱硝净化时,污染性气体脱除效率变化情况如图所示,则该脱除技术的最佳温度应为__℃,喷淋塔中可能产生的一种副产物的化学式为__,该物质的常见用途是__。

(4)传统湿式氨法烟气处理技术以尿素[CO(NH2)2]热水解产生的NH3溶于水为喷淋液。在催化剂作用下,喷淋除去NO过程中有一种无污染气体生成,该反应的化学方程式为__。
(5)该化工小组设定模拟烟气流量am3/h,进口NO质量浓度bmg/m3,吸收液循环量cL/h,通过离子色谱测定脱除前后吸收液中主要离子浓度如下表所示,则NO的脱除率为__(用含有a、b、c的代数式表示)。
离子种类 浓度数据 | ClO2 (mg/L) | Cl- (mg/L) | SO42- (mg/L) | SO32- (mg/L) | NO3- (mg/L) | NO2- (mg/L) |
吸收前 | 150 | 43.54 | —— | —— | —— | —— |
吸收后 | 12.62 | 110.49 | 213.64 | —— | 62.00 | —— |
反应前后差值 | 137.38 | 66.95 | 213.64 | —— | 62.00 | —— |
注:“——”表示该离子低于检测极限,可以认为不存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)可用于有机合成和药物制造等。实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2[SO2(g)+Cl2(g)![]() SO2Cl2(l) ΔH= -97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法错误的是
SO2Cl2(l) ΔH= -97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法错误的是
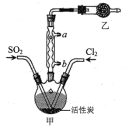
A.乙装置中盛放的试剂是P2O5,防止水蒸气进入装置中
B.装置甲应置于冰水浴中,目的是提高SO2Cl2产率
C.反应结束后,分离甲中混合物的实验操作是蒸馏
D.SO2、Cl2均可使品红试液褪色,原理不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
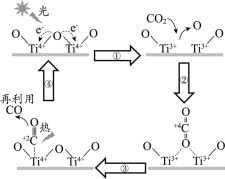
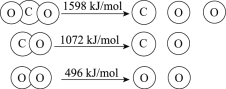
下列说法正确的是
A.过程①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D.CO2分解反应的热化学方程式为2CO2(g) =2CO(g) + O2(g) ΔH= + 30 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究苯酚与 FeCl3 溶液的显色反应,实验如下:
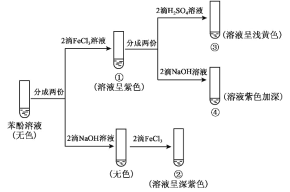
下列说法不正确的是( )
A.苯酚属于弱酸,电离方程式为![]()
![]() +H+
+H+
B.向试管②中滴加硫酸至过量,溶液颜色变为浅黄色
C.对比①③中的现象说明,滴加稀硫酸后,c(Fe3+)变小
D.对比①②、①④中的现象,说明紫色物质的生成与溶液中c(![]() )相关
)相关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下:
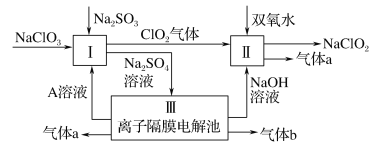
(1)Ⅰ中发生反应的还原剂是____ (填化学式)。
(2)Ⅱ中反应的离子方程式是____。
(3)Ⅲ中离子隔膜电解池的装置如下:
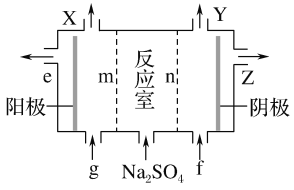
①A的化学式是________,A在____口产生。
②m为____ (填“阴”或“阳”)离子交换膜。
③结合化学用语和文字说明解释NaOH产生的原因:________
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
①该反应中氧化剂和还原剂的物质的量之比是____。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是____。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量前者____ (填“>”“<”或“=”)后者。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中微粒的物质的量浓度的关系,正确的是
A.0.1 mol·L-1的NH4Cl溶液与0.05 mol·L-1的NaOH溶液等体积混合的溶液:c(Cl-)>c(Na+)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.等物质的量的NaClO、NaHCO3混合溶液:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(![]() )
)
C.pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+)
D.某二元弱酸的酸式盐NaHA溶液:c(OH-)+c(H2A)=c(H+)+2c(A2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com