
【题目】已知3.6g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质C(s)的燃烧热为Y kJ·mol-1,则1 mol C(s)与O2(g)反应生成CO(g)的反应热ΔH为( )
A. -Y kJ·mol-1 B. -(5X-0.5Y)kJ·mol-1
C. -(10X-Y)kJ·mol-1 D. +(10X-Y)kJ·mol-1
【答案】B
【解析】碳在氧气中燃烧,氧气不足发生反应2C+O2![]() 2CO,氧气足量发生反应C+O2
2CO,氧气足量发生反应C+O2![]() CO2,3.6g碳的物质的量为
CO2,3.6g碳的物质的量为![]() =0.3mol,6.4g的氧气的物质的量为
=0.3mol,6.4g的氧气的物质的量为![]() =0.2mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生,令生成的CO为xmol,CO2为ymol,根据碳元素守恒有x+y=0.3,根据氧元素守恒有x+2y=0.2×2,联立方程,解得x=0.2,y=0.1,单质碳的燃烧热为Y kJ/mol,所以生成0.1mol二氧化碳放出的热量为0.1mol×Y kJ/mol=0.1YkJ,所以生成0.2molCO放出的热量为XkJ-0.1YkJ,由于碳燃烧为放热反应,所以反应热△H的符号为“-”,故1mol C与O2反应生成CO的反应热△H=-
=0.2mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生,令生成的CO为xmol,CO2为ymol,根据碳元素守恒有x+y=0.3,根据氧元素守恒有x+2y=0.2×2,联立方程,解得x=0.2,y=0.1,单质碳的燃烧热为Y kJ/mol,所以生成0.1mol二氧化碳放出的热量为0.1mol×Y kJ/mol=0.1YkJ,所以生成0.2molCO放出的热量为XkJ-0.1YkJ,由于碳燃烧为放热反应,所以反应热△H的符号为“-”,故1mol C与O2反应生成CO的反应热△H=-![]() =-(5X-0.5Y)kJ/mol,故选B。
=-(5X-0.5Y)kJ/mol,故选B。


科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。

根据上述实验,以下推测不正确的是
A. 原溶液一定不存在H+、Cu2+、CO32-
B. 不能确定原溶液是否含有K+、NO3-
C. 实验所加的NaOH的浓度为2mol·L-1
D. 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是
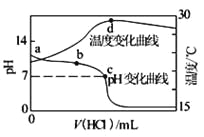
A. 氨水的电离程度a>b>c
B. a、d两点的溶液,水的离子积Kw(a)>Kw(d)
C. c点时消耗盐酸体积V(HCl)<20.00ml
D. d点时溶液温度达到最高,之后温度略有下降,原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
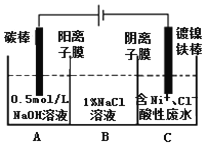
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶炼金属一般有以下几种方法:①热分解法;②焦炭法;③水煤气法(CO或H2);④活泼金属置换法;⑤电解法。这几种方法各有优缺点,它们在工业上均有应用。古代有:a.火烧孔雀石炼铜;b.湿法炼铜;现代有:c.铝热法炼铁;d.光卤石法炼镁。对它们的冶炼方法分析不正确的是
A. a用② B. b用③ C. c用④ D. d用⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系。下列物质组不满足上述转化关系的是( )
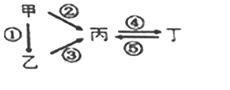
选项 | 甲 | 乙 | 丙 | 丁 |
A | N2 | NH3 | NO | NO2 |
B | Si | SiO2 | Na2SiO3 | Na2CO3 |
C | S | H2S | SO3 | H2SO4 |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)FeS2(二硫化亚铁)不溶于水,可溶于适量的稀硝酸中,离子反应式如下:
____ FeS2+ ____ H++ ____ NO3-= ____ Fe2++ ____ S↓+ ____ NO↑+ ____H2O
回答下列问题:配平此氧化还原反应方程式_____________________________________,还原剂为______________。
(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是_____(填字母)
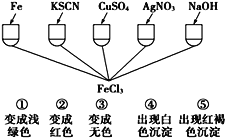
A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1L 0.2mol·L-1的FeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是________,此反应的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
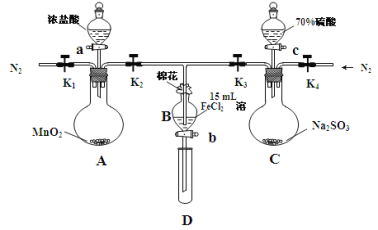
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_______________________________________________。
(2)棉花中浸润的溶液化学式为_________________________。
(3)A中发生反应的化学方程式为____________________________________。
(4)过程Ⅳ中检验其中Fe3+ 和Fe2+的试剂分别为___________和__________。
确定有Fe3+ 和Fe2+现象分别是_______________和____________________。
(5)过程Ⅵ,检验B溶液中是否含有SO42—的操作是_____________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:
过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO |
乙 | 既有Fe3+又有Fe2+ | 有SO |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
Cl2 > Fe3+ > SO2的是________(填“甲”“乙”“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化合物:①NaOH,②H2SO4,③CH3COOH,④NaCl,⑤CH3COONa,⑥NH4Cl,⑦CH3COONH4,⑧NH4H2SO4,⑨NH3·H2O,请回答下列问题:
(1)若浓度均为0.1mol·L-1、等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,
稀释后两种溶液的pH都变成9,则m_______n (填“>”、“<”或“=”)。
(2)已知水存在如下平衡:H2O+H2O![]() H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_______。
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_______。
A.向水中加入NaHSO4固体 B.向水中加NaHCO3固体
C.加热至100℃ [其中c (H+) =1×10-6 mol·L-1] D.向水中加入NH4Cl固体
(3)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=_______;在pH=3的CH3COOH溶液中,水电离出来的c(H+)=_______。
(4)NH4Cl溶液中离子浓度大小顺序为______________。
(5)物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)_______。
(6)己知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液a L与pH=2的H2SO4溶液bL混和(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则出a∶b=_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com