
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
 钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料.已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如图:
钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料.已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如图:| 反应序号 | 化学反应 | 反应热 |
| ① | Fe2O3(s)+3CO(g)=2Fe(s)+3CO 2(g) | △H1=-26.7kJ?mol-1 |
| ② | 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) | △H2=-50.8kJ?mol-1 |
| ③ | Fe3O4(s)+CO(g)=3FeO(s)+CO2 (g) | △H3=-36.5kJ?mol-1 |
| ④ | FeO(s)+CO(g)=Fe(s)+CO2(g) | △H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 1 |
| 2 |
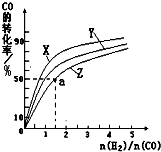
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com