
工业上生产金属钛的方法很多。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
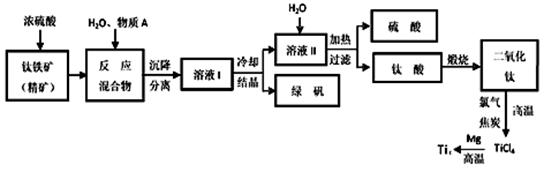
回答下列问题:
(1)钛铁矿和浓硫酸反应属于______________________ (选填“氧化还原反应”或“非
氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是________,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是__________、___________。
(3)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是_____________________。
 (4)由二氧化钛制取四氯化钛所涉及的反应有:
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2 (s)+ 2Cl2 (g) +2C(s) =TiCl4(g) + 2CO(g)
ΔH1 = -72 kJ•mol-1
TiO2(s) + 2Cl2 (g) =TiCl4(g) + O2 (g)
ΔH2 =+38.8kJ•mol-1
C(s)+CO2(g)=2CO(g) ΔH3 =+282.8kJ•mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行的原因是______________________。
②反应C(s)+O2(g)=CO2 (g)的ΔH=_______________。
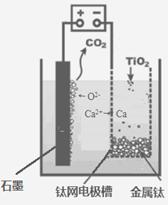
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
①写出阳极所发生反应的电极反应式:_______________________。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)
_________。
科目:高中化学 来源: 题型:
下列各组物质的无色溶液,不用其它试剂即可鉴别的是
①KOH Na2SO4 AlCl3 ②NaHCO3 Ba(OH)2 H2SO4
③HCl NaAlO2 NaHSO4 ④Ca(OH)2 Na2CO3 BaCl2
A.①② B.②③ C.①③④ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
若NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0℃、101 kPa时,22.4 L氢气中含有NA个氢原子
C.14 g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
西安北郊古墓中曾出土一青铜锤(一种酒具),表面附着有绿色固体物质,打开盖子酒香扑鼻,内盛有26 kg青绿色液体,专家认定是2000多年前的“西汉美酒”。这是我国考古界、酿酒界的一个重大发现。
(1)上述报道引发了某校化学兴趣小组同学的关注,他们收集家中铜器表面的绿色固体进行探究。
提出问题:铜器表面附着绿色固体物质是由哪些元素组成的?
猜想:查阅相关资料后,猜想绿色固体物质可能是铜绿。
实验步骤:

①对试管内的绿色固体进行加热,至完全分解。观察到A装置中绿色固体
逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀硫酸。观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。观察到铁丝表面有红色物质析出。
④实验结论:绿色固体物质中含有________、________、________、________等元素。(提示:装置内的空气因素忽略不计)(4分)
(2)表达与交流
①图中标有a、b的仪器名称是:a________;b________。
②上述实验步骤③中发生反应的离子方程式____________________________________。
③干燥管中的碱石灰作用是什么?若反应结束后,如果先移去酒精灯,可能出现的现象是什么?
④如果将B、C两装置对调行吗?________。为什么?____________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成: ① 与
与 ②
②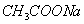 与NaOH ③
与NaOH ③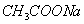 与
与 ④
④ 与
与 ,
,
下列各项排序正确的是
A.pH: ②>③>④>① B.  :②>④>③>①
:②>④>③>①
C.溶液中c(H+): ①>③>②>④ D.  : ①>④>③>②
: ①>④>③>②
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质间的反应,属于放热反应的是( )
A.碳酸钙的分解 B.碳与氧化铜加热条件下的反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合 D.H2与O2在点燃条件下的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2是最重要温室气体,如何降低大气中CO2的含量及有效地开发利用CO2具有重大意义。
(1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。
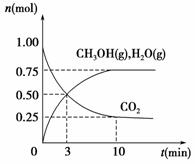
①写出该反应的化学方程式_______________________ 计算从反应开始到3 min时,氢气的平均反应速率v(H2)=____________________。
②下列措施中一定能使CO2的转化率增大的是___________________ 。
A 在原容器中再充入1 mol H2 B 在原容器中再充入1 mol CO2
C 缩小容器的容积 D 使用更有效的催化剂
E.在原容器中充入1 mol He F.将水蒸气从体系中分离出
(2)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为:2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
(3)在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。
|
n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①上述反应的a________0(填“大于”或“小于”)。
②恒温下,向反应体系中加入固体催化剂,则该反应的反应热a值________(填“增大”、“减小”或“不变”)。
③在一定温度下,增大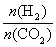 的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com