
若NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0℃、101 kPa时,22.4 L氢气中含有NA个氢原子
C.14 g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
科目:高中化学 来源: 题型:
下列有关物质检验的实验结论正确的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有 |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| D | 将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成 | 该物质一定属于醛类 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
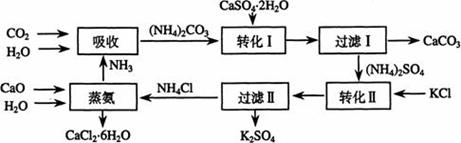
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要 等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有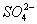 的方法是:
的方法是:
。
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体 g
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是
a 熔点较低(29℃熔化) b 能导电 c 能制冷 d 无毒
(7)上述工艺流程中体现绿色化学理念的是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,溶液颜色有明显变化的是
A.少量明矾溶液加入到过量NaOH溶液中
B.往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液
C.少量Na2O2固体加入到过量NaHSO3溶液中
D.往酸性高锰酸钾溶液中滴入少量Fe2(SO4)3稀溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

请填写下列空白:
(1)步骤①燃烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选取出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中正确的是: ( )
A.分液操作时,分液漏斗中的下层液体由下口放出,然后再将上层液体由下口放出
B. 用胶头滴管向试管滴加液体时,滴管尖端应紧靠试管内壁
用胶头滴管向试管滴加液体时,滴管尖端应紧靠试管内壁
C.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源: 题型:
由硫酸钾、硫酸铝和硫酸组成的混合溶液,c(H+)=0.1mol/L,c(Al3+)=0.4 mol/L, c(SO42—)=0.8 mol/L,则 c(K+)为( )
A. 0.15 mol/L B.0.2 mol/L C.0.3 mol/L D.0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上生产金属钛的方法很多。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
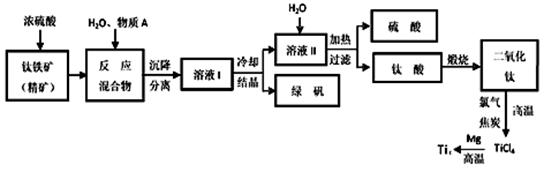
回答下列问题:
(1)钛铁矿和浓硫酸反应属于______________________ (选填“氧化还原反应”或“非
氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是________,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是__________、___________。
(3)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是_____________________。
 (4)由二氧化钛制取四氯化钛所涉及的反应有:
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2 (s)+ 2Cl2 (g) +2C(s) =TiCl4(g) + 2CO(g)
ΔH1 = -72 kJ•mol-1
TiO2(s) + 2Cl2 (g) =TiCl4(g) + O2 (g)
ΔH2 =+38.8kJ•mol-1
C(s)+CO2(g)=2CO(g) ΔH3 =+282.8kJ•mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行的原因是______________________。
②反应C(s)+O2(g)=CO2 (g)的ΔH=_______________。
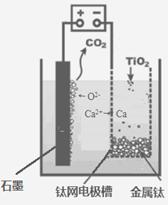
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
①写出阳极所发生反应的电极反应式:_______________________。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)
_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知CO和H2的混合气体称为水煤气,可由碳与水蒸气在高温下反应生成。如下图:

高温
反应①

 高温
高温
反应②
燃烧
反应③
已知:单质E可作为半导体材料,化合物F是有毒的氧化物,C为液态。据此,请填空:
(1)氧化物A是
(2)化合物F是
(3)反应②的化学方程式是
(4)反应③的化学方程式是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com