
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 黄绿色的氯水光照后颜色变浅
B. 温度过高对合成氨不利
C. 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
D. 溴水中有平衡:Br2+ H2O![]() HBr+ HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+ HBrO,当加入AgNO3溶液后,溶液颜色变浅
【答案】C
【解析】
氯气为黄绿色气体,部分溶解于水中,部分与水发生可逆反应产生次氯酸,次氯酸受光易分解;氨气合成反应放热,升高温度平衡逆向移动;溴水颜色主要由溶于水的溴单质产生,加入硝酸银溶液,银离子与溴离子反应产生溴化银沉淀,使溴水平衡正向移动,溴单质减小。
A. 氯气为黄绿色气体,部分溶解于水中,部分与水发生可逆反应产生次氯酸H2O+Cl2=HCl+HClO,次氯酸受光易分解,产物浓度降低,根据勒夏特列原理,反应向着减弱变化的方向移动,故平衡正向移动,氯气浓度降低,黄绿色的氯水颜色变浅,A错误;
B. 合成氨反应3H2+N2=2NH3,反应放热,根据勒夏特列原理,温度升高,平衡向降温方向移动,故反应逆向移动,不利于合成氨,B错误
C. 由H2、I2蒸气、HI组成的平衡体系H2+I2=2HI,反应前后气体体积不变,故增大压强,反应平衡不移动,加压后颜色变深是由于碘单质浓缩导致,C正确;
D. 溴水中有平衡:Br2+ H2O![]() HBr+ HBrO,当加入AgNO3溶液后,溴离子与银离子结合产生溴化银沉淀,使平衡正向移动,溴水中溴单质浓度减少,溶液颜色变浅,D错误;
HBr+ HBrO,当加入AgNO3溶液后,溴离子与银离子结合产生溴化银沉淀,使平衡正向移动,溴水中溴单质浓度减少,溶液颜色变浅,D错误;
答案为C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在两个绝热恒容的密闭容器中分别进行下列两个可逆反应:
甲:C(s)+H2O(g) ![]() CO(g)+H2(g);
CO(g)+H2(g);
乙:CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:
①混合气体平均相对分子质量不再改变
②气体的总物质的量不再改变
③各气体组成浓度相等
④反应体系中温度保持不变
⑤断裂氢氧键速率是断裂氢氢键速率的2倍
⑥混合气体密度不变
其中能表明甲、乙容器中反应都达到平衡状态的是
A. ①③B. ④⑤C. ③④D. ②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应的实验,能够达到实验目的的是( )

A. 实验室制取少量硝基苯 B. 证明溴乙烷、NaOH、乙醇溶液共热生成乙烯
C. 分离乙酸乙酯、碳酸钠和水的混合物 D. 证明乙醇浓硫酸共热生成乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式或离子方程式,书写规范、正确的是(反应条件略)
A. 
B. 
C. 苯酚钠溶液中通入少量二氧化碳的离子方程式:![]() +H2O+CO2→
+H2O+CO2→![]() +HCO3-
+HCO3-
D. 乙酸与碳酸钠溶液反应的离子方程式:2H++CO32-=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2mol·L-1H2B溶液中滴加0.2mol·L-1NaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ表示H2B,Ⅱ代表HB-、Ⅲ代表B2-),根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是
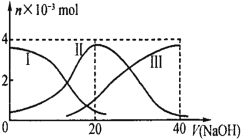
A. c(Na+)>c(HB-)>c(H+)>c(B2-)>c(H2B)
B. c(Na+)>c(HB-)>c(OH-)>c(H2B)>c(H+)>c(B2-)
C. c(Na+)>c(H+)>c(HB-)>c(B2-)>c(OH-)>c(H2B)
D. c(Na+)>c(OH-)>c(HB-)>c(H2B)>c(H+)>c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的体积扩大一倍,测得A的浓度变为0.15 mol/L,下列有关判断正确的是( )
zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的体积扩大一倍,测得A的浓度变为0.15 mol/L,下列有关判断正确的是( )
A. x+y<z B. 平衡逆向移动 C. A的转化率降低 D. C的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,则下列结论中正确的是( )

①铜为阳极,锌为阴极;②铜极上有气泡;③SO42-向铜极移动;④若有0.5 mol 电子流经导线,则可产生0.25 mol气体;⑤电子的流向是铜到锌;⑥正极反应式:Cu+2e-=Cu2+。
A. ①②③ B. ②④ C. ④⑤⑥ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种元素,其原子的核电荷数均小于18,且依次递增,A原子核内仅有一个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D的最外层电子数是次外层电子数的3倍;E的最高价氧化物的水化物具有两性;F的单质是用途最广泛的半导体材料。
试推断以上元素并回答下列问题:
(1)写出相应的元素符号: B________,C________,D_______, F________。
(2)B、C、D的气态氢化物的稳定性由大到小的顺序为__________(用化学式表示)。
(3)画出D的离子结构示意图________。
(4)用一个化学方程式证明B、F的非金属性的强弱____________________________。
(5)写出E的最高价氧化物的水化物与NaOH溶液反应的离子方程式:__________________。
(6)由元素D形成的10电子简单离子的符号为________,由元素F形成的18电子分子的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED即发光二极管,是一种能够将电能转化为光能的固态半导体器件。如图是某课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是

A. 装置中存在“化学能→电能→光能”的转化
B. 铜片上发生的反应为2H++2e-=H2↑
C. 锌片是负极,其质量逐渐减小
D. 如果将稀硫酸换成稀盐酸,则导线中不会有电子流动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com