
����Ŀ��ij����С������ͼװ�ý���ʵ�飬�Իش�����������

��1������ʼʱ����K��a���ӣ���B���ĵ缫��ӦʽΪ______________��
��2������ʼʱ����K��b���ӣ���B���ĵ缫��ӦʽΪ__________���ܷ�Ӧ�����ӷ���ʽΪ____________��
��3������ʼʱ����K��b����.����˵����ȷ����_______��
A.��Һ��Na����A���ƶ�
B.��A�����ݳ���������ʹʪ���KI������ֽ����
C.��Ӧһ��ʱ������������ɻָ������ǰ����ʵ�Ũ��
D.����״����B������2.24 L���壬����Һ��ת��0.2 mol����
��4����С��ͬѧ��Ϊ�����ģ�ҵ�����ӽ���Ĥ�����ռ�ķ�������ô������������ͼװ�õ���������Һ����ȡ������������������������ء�
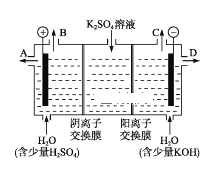
���õ��۵�������ӦʽΪ________��
���Ƶõ�����������Һ�ӳ���(����A������B������C���� ��D��)________������
��������������������������ǿ����ƽ���ƶ�ԭ������ԭ��_________________________��
���𰸡�Fe-2e- = Fe2�� 2H��+2e- = H2�� 2Cl-+2H2O=2OH��+ H2��+ Cl2�� B 2H2O��4e- =4H�� +O2������4OH�D�D4e����2H2O��O2���� D H2O![]() H��+ OH����H�������������ŵ磬����ˮ�ĵ���ƽ�������ƶ���ʹc(OH��)>c(H��)����Һ�Լ���
H��+ OH����H�������������ŵ磬����ˮ�ĵ���ƽ�������ƶ���ʹc(OH��)>c(H��)����Һ�Լ���
��������
(1)��ʼʱ����K��a�����γ�ԭ��ط�Ӧ��B�缫��������ʧ���������������ӣ��缫��ӦΪ��Fe-2e-=Fe2+���ʴ�Ϊ��Fe-2e-=Fe2+��
(2)����K��b���ӣ�װ��Ϊ���أ���Ϊ������������ԭ��Ӧ�������ӵõ�����������������B�缫��ӦΪ2H++2e-=H2������ⱥ��ʳ��ˮ�����������ơ�����������������ܷ�Ӧ�����ӷ���ʽΪ2Cl-+2H2O ![]() 2OH-+H2��+Cl2�����ʴ�Ϊ��2H++2e-=H2����2Cl-+2H2O
2OH-+H2��+Cl2�����ʴ�Ϊ��2H++2e-=H2����2Cl-+2H2O ![]() 2OH-+H2��+Cl2����
2OH-+H2��+Cl2����
(3)A�����������������������ƶ���BΪ��������Һ��Na+��B���ƶ�����A����B��A�������������������ܹ��û����⻯����Һ�еĵ����ɵⵥ�ʣ��������۱�������B��ȷ��C����Ӧһ��ʱ��������HCl���壬�ɻָ������ǰ����ʵ�Ũ�ȣ����Ǽ������ᣬ��C����D������״����B������2.24L���������ʵ���Ϊ0.1mol�����ݵ缫��Ӧʽ2H++2e-=H2��֪����·��ת��0.2mol���ӣ������Ӳ��ܾ�����Һ����D���ʴ�Ϊ��B��
(4)�ٵ��ʱ��������ʧ���ӷ���������Ӧ����Һ�е����������ӵķŵ�����������������ӣ���������������������ʧ��������ˮ��������������ҺΪ���ᣬ�ʵ缫��ӦʽΪ2H2O��4e- =4H�� +O2��(��4OH�D�D4e����2H2O��O2��)���ʴ�Ϊ��2H2O��4e- =4H�� +O2��(��4OH�D�D4e����2H2O��O2��)��
���������������ӷŵ磬�������������������ƶ������������ӷŵ磬��˼������������ƶ����������������������������ɣ���������������Һ�ӳ���D�������ʴ�Ϊ��D��
�۵���������������ˮ������������ӷŵ磬2H++2e-=H2��������ˮ�ĵ���ƽ�������ƶ�����������������Ũ�ȴ��������ӣ���Һ��ʾ���ԣ��ʴ�Ϊ��H2O![]() H��+ OH����H�������������ŵ磬����ˮ�ĵ���ƽ�������ƶ���ʹc(OH��)>c(H��)����Һ��ʾ������
H��+ OH����H�������������ŵ磬����ˮ�ĵ���ƽ�������ƶ���ʹc(OH��)>c(H��)����Һ��ʾ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�õ��жϣ�������ȷ����( )

A����ߵ�װ���ǵ��أ��ұߵ�װ����ԭ���
B����װ����ͭΪ������пΪ����
C����ͭƬ�������仯Ϊ12.8 gʱ��a�������ĵ�O2�ڱ�״���µ����Ϊ2.24 L
D��װ���еĵ��������ǣ�a��Cu������CuSO4��Һ��Zn��b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������У������ԭ��ص���( )
A | B | C | D | |
�������� | ZnƬ��CuƬ | CuƬ�� CuƬ | ZnƬ��CuƬ | ZnƬ��CuƬ |
������Һ | ϡH2SO4 | NaCl��Һ | ֲ���� | �ƾ� |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����������β���ŷų���SO2��NOx�ȣ����γ���������Ҫ���أ������ɿ����еĻҳ������ᡢ���ᡢ�л�̼�⻯����������γɵ�������
��1��NOx��SO2�ڿ����д�������ƽ�⣺
��. 2NO(g)��O2(g)![]() 2NO2(g) H=��113.0 kJ mol-1
2NO2(g) H=��113.0 kJ mol-1
��. 2SO2(g)��O2(g)![]() 2SO3(g) H=��196.6 kJ mol-1
2SO3(g) H=��196.6 kJ mol-1
��������ͨ���ڶ��������Ĵ����£���һ������������������������
��д��NO2��SO2��Ӧ���Ȼ�ѧ����ʽΪ______��
�ڷ�Ӧ���Է����е�������______�������ϸ��������ϵ����������κ��¶�������
��2�����2SO2(g)��O2(g) ![]() 2SO3(g)��Ӧ��SO2��ת���ʣ��Ǽ���SO2�ŷŵ���Ч��ʩ��
2SO3(g)��Ӧ��SO2��ת���ʣ��Ǽ���SO2�ŷŵ���Ч��ʩ��
��T�¶�ʱ����2L���ܱ������м���2.0mol SO2��1.0mol O2��5min��Ӧ�ﵽƽ�⣬���������ת����Ϊ50%���÷�Ӧ��ƽ�ⳣ����______��
���ڢ��������£���Ӧ�ﵽƽ���ı�������������ʹSO2��ת������ߵ���______������ĸ����
a.�¶Ⱥ�����������䣬����1.0mol He
b.�¶Ⱥ�����������䣬����1.0mol O2
c.��������������ʱ���������������
d.��������������ʱ�����ø�Ч����
e.��������������ʱ��������ϵ�¶�
��3�����NO�Ʊ�NH4NO3���乤��ԭ����ͼ��ʾ�������ĵ缫��ӦʽΪ_____________________________��Ϊʹ������ȫ��ת��ΪNH4NO3���貹��������_____��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�������Ũ���ᷴӦ��ʵ���У�����˵����ȷ����
A.��Ӧ��Ҫ���������ˮ������
B.��Ӧ��Ҫʹ�þƾ��Ƽ���
C.Ũ����ֻ���ֳ���ˮ��
D.�����Ĵ̼�����ζ������SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֲ���纣���������к��зḻ�ĵ�Ԫ�أ���Ҫ�Ե⻯����ʽ���ڡ�ij����С���ú���Ϊԭ����ȡ�����ⵥ�ʣ����ǽ��������ճɻң���ˮ����һ��ʱ��(���õ⻯�����ܽ���ˮ��)���õ� ����������Һ���ٰ�����ʵ��������ȡ���ʵ⣺

��1��ʵ������ٵ����ƣ�__________��
��2���������պ�����ʵ��������_________��(ѡ����ĸ)
A���ձ� B�������� C���Թ� D������
��3�������������õ��л��ܼ�������__________��(ѡ����ĸ)
A�������е�80�棩 B�����Ȼ�̼���е�76.8�棩
C���ƾ����е� 78�棩 D���ѻ����ͣ�����ⷴӦ��
��4���������̢ۿ��Էֽ�Ϊ���¼�����
A����ʢ����Һ�ķ�Һ©����������̨����Ȧ�У�
B����50mL��ˮ��15mL�л��ܼ�(����ѡ��)�����Һ©���У����Ǻò�������
C�������Һ©���������ϿڵIJ������Ƿ�©Һ��
D����ת©������������ʱ�����������������رջ������ѷ�Һ©��������
E���������������ձ�������Һ��
F���ӷ�Һ©���Ͽڵ����ϲ�Һ�壻
G����©���ϿڵIJ�������ʹ���ϵİ�����©���Ͽڵ�С����
H�����á��ֲ㡣
������������ȷ˳���ǣ�____________(����ĸ��ʾ)
��5���Ӻ�����л���Һ����ȡ��ͻ����л��ܼ�������Ҫ����������ͼ������ˮԡ���ȵķ�ʽ���� �����ʵ��װ�ã����д������_________��������ķе�184.3�棩

��6����ʵ���������ʱ��ʹ��ˮԡ���ȵ��ŵ���________�����̬����________��ۼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݴ����ᴿ��ԭ������ȥ�Ȼ�����Һ���������Ȼ�þ������þ�����ʣ���ѡ������������Һ��ϡ�����̼�����Һ�����Լ�������ͼ���������
![]()
![]() ��Һ
��Һ![]()
![]()
![]()
![]() �����Ȼ�����Һ
�����Ȼ�����Һ
��1��A�Ļ�ѧʽ��_______��B�Ļ�ѧʽ��______��C��������_______��
��2���������A��Ŀ����________��
��3���������������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ΪV L�ĺ����ܱ�������ʢ��һ����H2��ͨ��Br2(g)������Ӧ��H2(g)��Br2(g)![]() 2HBr(g) ��H��0�����¶ȷֱ�ΪT1��T2��ƽ��ʱ��H2�����������Br2(g)�����ʵ����仯��ϵ����ͼ��ʾ������˵����ȷ����
2HBr(g) ��H��0�����¶ȷֱ�ΪT1��T2��ƽ��ʱ��H2�����������Br2(g)�����ʵ����仯��ϵ����ͼ��ʾ������˵����ȷ����

A. ��ͼ��֪��T1��T2
B. a��b����ķ�Ӧ���ʣ�b��a
C. Ϊ�����Br2(g)��ת���ʣ��ɲ�ȡ��HBrҺ������ʱ���ߵķ���
D. T1ʱ������Br2(g)���룬ƽ��ʱHBr�����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]
�黯�أ�GaAs���������İ뵼����ϣ������������ͼ�������̫���ܵ�صIJ��ϵȡ��ش��������⣺
��1��д����̬Asԭ�ӵĺ�������Ų�ʽ________________________��
��2������Ԫ�������ɣ�ԭ�Ӱ뾶Ga_____________As����һ������Ga____________As������������������С������
��3��AsCl3���ӵ����幹��Ϊ____________________������As���ӻ��������Ϊ_________��
��4��GaF3���۵����1000����GaCl3���۵�Ϊ77.9������ԭ����_____________________��
��5��GaAs���۵�Ϊ1238�����ܶ�Ϊ��g��cm-3���侧���ṹ��ͼ��ʾ���þ��������Ϊ________________,Ga��As��________�����ϡ�Ga��As��Ħ�������ֱ�ΪMGag��mol-1��MAs g��mol-1��ԭ�Ӱ뾶�ֱ�ΪrGapm��rAspm������٤������ֵΪNA����GaAs������ԭ�ӵ����ռ��������İٷ���Ϊ____________________��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com