
将一含SiO2杂质的石灰石样品100g加强热反应后,质量变为60.4 g。试计算:
(1)生成是气体在标准状况下的体积。
(2)该石灰石的纯度(碳酸钙的质量分数)。
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
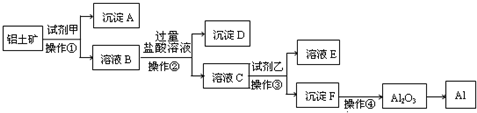
| 冰晶石 |
| ||
| 冰晶石 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(5分)现有一含少量SiO2杂质的石灰石样品,某实验小组同学为准确测定该样品的纯度,他们取用2.0g样品于烧杯中,把25.00mL某浓度的盐酸分成5等份,准备分别加入烧杯中进行反应,他们将前4次实验的结果记录如下:
| 次序 | 盐酸 | 剩余固体 |
| 1 | 先加入5.00mL | 1.32g |
| 2 | 再加入5.00mL | 0.64g |
| 3 | 再加入5.00mL | 0.2g |
| 4 | 再加入5.00mL | 0.2g |
(1)该实验小组同学是否还需要将第5份盐酸加入烧杯? ;
(2)原样品的纯度(CaCO3的质量分数)是______________。
(3)求该实验小组同学所用盐酸的物质的量浓度。(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源:鲁必修1第4章 元素与材料世界练习 题型:计算题
将一含SiO2杂质的石灰石样品100g加强热反应后,质量变为60.4 g。试计算:
(1)生成是气体在标准状况下的体积。
(2)该石灰石的纯度(碳酸钙的质量分数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com