

| ||
| ||
| 3.9g |
| 78g/mol |
| 0.05mol |
| 5mol/L |
| 0.25mol |
| 5mol/L |


科目:高中化学 来源: 题型:
 甲、乙两个探究性学习小组,拟在实验室中通过铝与足量的稀硫酸反应生成的氢气来测定铝的摩尔质量.
甲、乙两个探究性学习小组,拟在实验室中通过铝与足量的稀硫酸反应生成的氢气来测定铝的摩尔质量.| 实验前 | 实验后 | |
| 铝铜合金质量/g | m1 | m2 |
| 量液管(C)液面读数/mL | V1 | V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一,在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒,除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一,在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒,除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学用如图所示的装置研究不同电解质溶液中Mg和Al的活泼性.请回答下列问题:
某同学用如图所示的装置研究不同电解质溶液中Mg和Al的活泼性.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
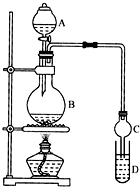 乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
| 浓H2SO4 |
| 140℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、由-CH3、 、-OH、-COOH四种原子团两两组合形成的有机物中,属于弱电解质的有4种 、-OH、-COOH四种原子团两两组合形成的有机物中,属于弱电解质的有4种 | ||
B、向含有 溶液中分别加入少量NaOH固体、少量浓盐酸或少量酸性高锰酸钾溶液,都能使其浓度下降 溶液中分别加入少量NaOH固体、少量浓盐酸或少量酸性高锰酸钾溶液,都能使其浓度下降 | ||
C、有机物X、Y、M的转化关系为淀粉→X→Y
| ||
D、高分子化合物 ,其链节为对苯二甲酸和乙二醇 ,其链节为对苯二甲酸和乙二醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述反应属于置换反应 |
| B、该反应中的氧化剂与还原剂的物质的量之比为2:l |
| C、Cu2HgI4既是氧化产物又是还原产物 |
| D、当有1 mol CuI参与反应时,转移电子的物质的量为0.5 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com