
| 8g |
| 160g/mol |
| 46.6g |
| 233g/mol |
| 8g |
| 160g/mol |
| 46.6g |
| 233g/mol |
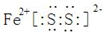 ,
,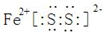 ;
;

科目:高中化学 来源: 题型:
 如图所示为高温超导领域里的一种化合物--钙钛矿晶体结构,该结构是具有代表性的最小重复单位.
如图所示为高温超导领域里的一种化合物--钙钛矿晶体结构,该结构是具有代表性的最小重复单位.查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物均未列出).
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物均未列出).查看答案和解析>>
科目:高中化学 来源: 题型:
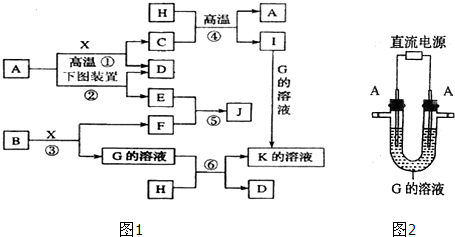
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、电子通过外电路从b极流向a极 |
| B、H+由a极通过固体酸电解质传递到b极 |
| C、b极上的电极反应式为:O2+2H2O+4e-═4OH- |
| D、每转移0.1mol电子,消耗1.12L的H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com