
| 10-14 |
| 10-9 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| Ksp[Mg(OH)2] | Ksp[Fe(OH)3] | 氨气的饱和溶液 |
| 1.8×10-11 | 4.0×10-38 | c(OH-)=1×10-3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
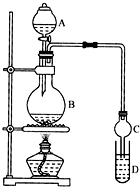 乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
| 浓H2SO4 |
| 140℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4+Cl2→CH3Cl+HCl 取代反应 | ||
B、CH2=CH2+HCl
| ||
C、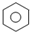 +Br2 +Br2
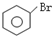 +HBr 取代反应 +HBr 取代反应 | ||
D、2CH3CH2OH+O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ni的还原性比铁稍弱,可采用金属铝作还原剂的热还原法 |
| B、在新制的氯水中加入NaOH溶液至中性时,满足C(Na+)═C(ClO-)+C(HClO) |
| C、在某溶液中加入K3Fe(CN)6若产生蓝色沉淀即可证明Fe3+ 的存 |
| D、在相同温度下,向1mL 0.2mol?L-1 NaOH溶液中滴入2滴0.1 mol?L-1 MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol?L-1 FeCl3溶液,又生成红褐色沉淀,可证明Fe(OH)3的溶解度小于Mg(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com