

| ||
| ||


科目:高中化学 来源: 题型:

| ||
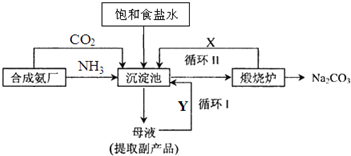
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
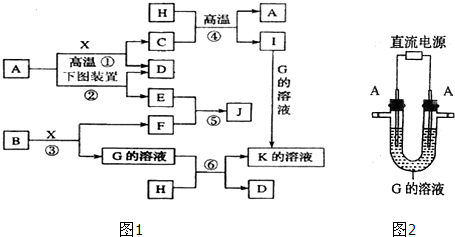
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1.恒温条件下,容积为1L的恒容容器中,硫可以发生如下转化,其反应过程和能量关系如图所示.
已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1.恒温条件下,容积为1L的恒容容器中,硫可以发生如下转化,其反应过程和能量关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据△H可以判断此反应是放热反应还是吸热反应 |
| B、根据化学反应速率可以判断反应物转变为生成物的难易 |
| C、根据熵变还不可以判断化学反应能否自发进行 |
| D、根据化学平衡常数可以判断化学反应进行的限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体的压强不再发生变化 |
| B、混合气体的密度不再发生变化 |
| C、反应容器中N2、NH3的物质的量的比值不再发生变化 |
| D、单位时间内断开a个H-H键的同时形成3a个N-H键 |
| E、三种物质的浓度之比恰好等于化学方程式中各物质的化学计量数之比 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com